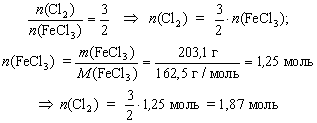С. Т. Жуков Химия 8-9 класс
Глава 5.Важнейшие физические величины ,
соотношения и расчеты в химии(2)
5.7. Относительная плотность
| Относительная плотность вещества Б –
отношение плотности вещества Б к плотности
вещества А, взятого за эталон. |
Относительная плотность dA(Б)
показывает, во сколько раз плотность данного
вещества (Б) больше плотности эталонного
вещества (А)
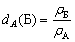
Как и все относительные величины,
относительная плотность – величина
безразмерная.
Для твердых и жидких веществ в качестве эталона
обычно берется чистая вода (плотность воды – 1
г/мл), и тогда относительная плотность, оставаясь
безразмерной, оказывается численно равной
обычной плотности.
Для газов за эталон чаще всего берется сухой
воздух (при н. у, плотность воздуха – 1,293 кг/м3
или 0,001293 г/см3), но может быть взят и любой
другой газ. Для идеальных газов относительная
плотность равна
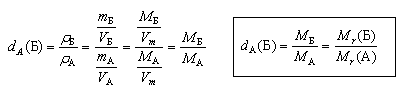
и, таким образом, не зависит от давления и
температуры. Эти соотношения с достаточно
высокой точностью справедливы и для реальных
газов при обычных давлениях.
 ОТНОСИТЕЛЬНАЯ
ПЛОТНОСТЬ ВЕЩЕСТВА
ОТНОСИТЕЛЬНАЯ
ПЛОТНОСТЬ ВЕЩЕСТВА
 1.Плотность
глицерина 1,26 г/мл, а плотность хлорида натрия 2,16
г/см3. Определите относительную плотность
а) глицерина по воде, б) хлорида натрия по воде, в)
хлорида натрия по глицерину.
1.Плотность
глицерина 1,26 г/мл, а плотность хлорида натрия 2,16
г/см3. Определите относительную плотность
а) глицерина по воде, б) хлорида натрия по воде, в)
хлорида натрия по глицерину.
2. Определите плотность по азоту а) аммиака, б)
метана, в) углекислого газа.
3.Определите относительную плотность хлора по
аргону и аргона по хлору. Как связаны между собой
эти величины? Запишите уравнение связи в общем
виде.
4.Определите молярную массу неизвестного газа,
если плотность его по водороду равна 35,5. Как вы
думаете, какой это может быть газ?
5.Известно, что в состав неизвестного газа входят
кремний и водород. Плотность газа по водороду
равна 16. Составьте молекулярную формулу этого
газа.
5.8. Доли компонентов
Для количественной характеристики состава
вещества, смеси или раствора используются
величины, называемые долями компонентов
(составных частей) системы или просто долями.
Рассчитывают мольные (x), объемные ( ) и массовые (w) доли
компонентов. Нам с вами придется определять доли
элемента в соединении, а также доли вещества в
смеси или растворе.
) и массовые (w) доли
компонентов. Нам с вами придется определять доли
элемента в соединении, а также доли вещества в
смеси или растворе.
Все доли – величины относительные, а потому
безразмерные, и их значения не зависят от размера
порции вещества, для которого они определены.
| Мольная доля элемента в соединении – отношение
количества вещества данного элемента к сумме
количеств вещества всех элементов, входящих в
соединение. |
Например, мольная доля водорода в воде
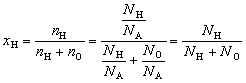 .
.
Так как доля не зависит от порции, то порцией
может быть и одна молекула – H2O. Тогда
очевидно, что NH = 2, а NO = 1 и xH
= 2/3  0,667.
0,667.
| Мольная доля вещества Б в смеси или растворе
– отношение количества вещества Б к сумме
количеств вещества всех компонентов смеси или
раствора. |
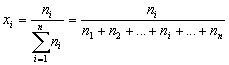
Если для приготовления раствора взяли 47 молей
воды и 3 моля какой-нибудь соли, то мольная доля
соли в полученном растворе
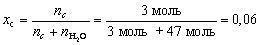 .
.
Объемная доля вещества Б в смеси или
растворе – отношение объема вещества Б к
объему смеси или раствора.
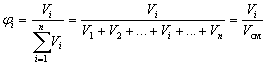
Если смешать 2 л водорода, 4 литра азота и 6
литров углекислого газа, то объемная доля азота в
этой смеси
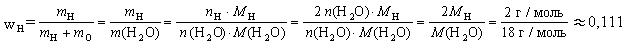
Объемная доля компонента смеси имеет смысл
только в тех случаях, когда объем смеси равен
сумме объемов отдельных компонентов этой смеси,
что ограничивает применение этой величины
(используется, как правило, только для смесей
газов).
Массовая доля элемента в
соединении – отношение массы данного элемента
к массе всей порции вещества. |
| Массовая доля вещества Б в смеси или растворе
– отношение массы вещества Б к массе смеси или
раствора. |
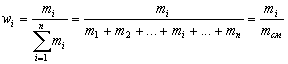
Например, массовая доля водорода в воде
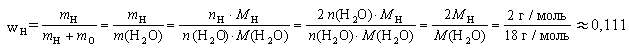
Если при приготовлении раствора взяли 25 г воды
и 5 г какой-либо соли, то массовая доля соли в
полученном растворе
wc = 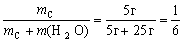
 0,167
0,167
Объемная доля элемента в соединении не имеет
смысла.
Умножив числитель и знаменатель в развернутом
выражении мольной доли на постоянную Авогадро,
мы получим " штучную" долю (см. параграф 4.3),
то есть для любых веществ Di = xi,
но мольная доля используется в тех случаях, когда
частиц очень много, и их .удобно пересчитывать не
поштучно, а в молях.
Для газов, в соответствии с законом Авогадро,  i = xi. Значения
мольных или объемных долей газов в смеси
используется для расчета средней молекулярной
массы или средней молярной массы этой смеси
газов.
i = xi. Значения
мольных или объемных долей газов в смеси
используется для расчета средней молекулярной
массы или средней молярной массы этой смеси
газов.
При расчете этих величин для смеси твердых или
жидких веществ можно использовать только
мольные доли.
| Водород – H2 – бесцветный газ с очень
низкой температурой кипения (20 К, или –253 oС).
Водород – самый легкий газ, его относительная
плотность по воздуху равна примерно 0,07, поэтому
водородом часто заполняют аэростаты и воздушные
шары. Жидкий водород используют как компонент
ракетного топлива (горючее). Смесь водорода с
кислородом в объемном отношении 2:1 (гремучий газ)
взрывается от электрической искры или
поджигания, образуя воду. Водород вступает в
реакции как с металлами, так и со многими
неметаллами, образуя гидриды. Он используется в
органических синтезах и других современных
технологиях. Азот – N2. Из всех
известных газов, не считая благородных, азот
является самым инертным, его двухатомная
молекула – одна из самых прочных. Объемная доля
азота в воздухе – 78,09 %. Из жидкого воздуха его и
получают в промышленности, используя разницу в
температурах кипения кислорода и азота (90 К и 77 К
соответственно). Газообразный азот используется
для заполнения колб электрических ламп
накаливания, в качестве инертной среды для
проведения некоторых химических реакций, для
синтеза аммиака, а жидкий азот – в технике низких
температур (криогенной технике). |
 МОЛЬНАЯ
ДОЛЯ ЭЛЕМЕНТА В СОЕДИНЕНИИ, МОЛЬНАЯ ДОЛЯ
ВЕЩЕСТВА В СМЕСИ,ОБЪЕМНАЯ ДОЛЯ ВЕЩЕСТВА В СМЕСИ,
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В СОЕДИНЕНИИ ,
МАССОВАЯ ДОЛЯ ВЕЩЕСТВА В СМЕСИ
МОЛЬНАЯ
ДОЛЯ ЭЛЕМЕНТА В СОЕДИНЕНИИ, МОЛЬНАЯ ДОЛЯ
ВЕЩЕСТВА В СМЕСИ,ОБЪЕМНАЯ ДОЛЯ ВЕЩЕСТВА В СМЕСИ,
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В СОЕДИНЕНИИ ,
МАССОВАЯ ДОЛЯ ВЕЩЕСТВА В СМЕСИ
 1.Определите
мольные доли элементов, входящих в состав а)
аммиака, б) серной кислоты, в) фосфата кальция.
1.Определите
мольные доли элементов, входящих в состав а)
аммиака, б) серной кислоты, в) фосфата кальция.
2.Определите объемную долю кислорода в смеси его
с углекислым газом, если смешали 2 л кислорода и 4
л углекислого газа (газы при смешивании
находились при одинаковых условиях).
3.В смеси азота и водорода объемная доля водорода
составляет 75 %. Определите объем азота,
необходимого для приготовления 200 л такой смеси.
4.Определите массовые доли элементов, входящих в
состав а) аммиака NH3, б) серной кислоты H2SO4,
в) фосфата кальция Ca3(PO4)2.
5.В смеси алюминия с йодом массовая доля алюминия
равна 20 %. Определите мольные доли алюминия и йода
в этой смеси. В каком массовом отношении взяты
алюминий и йод? В каком мольном отношении
(отношении количеств вещества) взяты эти
вещества?
6.Докажите, что для одной и той же системы
(например, смеси веществ)  .
.
7.Определите среднюю молекулярную массу смеси
монооксида и диоксида азота, если объемная доля
монооксида в ней равна 0,6.
8.Состав сухого воздуха в массовых долях: азот –
0,7553; кислород – 0,2314; аргон – 0,0128; углекислый газ
– 0,0005. Рассчитайте мольные доли компонентов
воздуха.
9.Определите среднюю молярную и среднюю
молекулярную массу воздуха. Определите
плотность по воздуху а) водорода, б) сероводорода,
в) хлора. При решении воспользуйтесь ответами
предыдущей задачи.
5.9. Концентрация
Кроме долей компонентов в смеси или растворе
для количественной характеристики состава
системы используется величина, которая
называется концентрация компонента, или
просто концентрация.
Концентрация компонента Б – отношение
количества вещества компонента Б к объему
системы. |
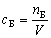 `
`
Единица измерений концентрации [сБ] = 1
моль/м3, но чаще – 1 моль/л. В последнем
случае концентрация компонента Б показывает,
какое количество вещества этого компонента
содержится в 1 литре раствора. Например, при
концентрации 0,25 моль/л в одном литре раствора
содержится четверть моля растворенного
вещества.
В химии часто используется специальная
терминология для обозначения концентраций. Так
раствор с концентрацией компонента 1 моль/л
называется одномолярным раствором этого
вещества и обозначается 1М. " 1М раствор КОН в H20"
читается: " одномолярный раствор гидроксида
калия в воде" . В обозначении молярности
раствора применяются десятичные приставки,
например:
0,1М раствор – децимолярный раствор;
0,01М раствор – сантимолярный раствор;
0,001М раствор – миллимолярный раствор;
0,2М раствор – двудецимолярный раствор;
0,05М раствор – пятисантимолярный раствор;
0,025М раствор – двадцатипятимиллимолярный
раствор.
Последняя запись, например, означает, что в 1 л
раствора содержится 0,025 моль растворенного
вещества.
В физике часто используется родственная
физическая величина – концентрация молекул
компонента Б в смеси веществ (в общем случае – концентрация
частиц компонента Б в смеси).
| Концентрация молекул (частиц) компонента Б – отношение
числа молекул (частиц) компонента Б к объему
системы |
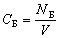
Единицы измерений концентрации молекул [СБ ] =
1 м– 3 или 1 л– 1. Смысл этих единиц
измерений – " одна штука в кубометре" и "
одна штука в литре" .
Концентрация молекул компонента Б показывает,
сколько молекул вещества Б содержится в одном
кубометре или одном литре смеси или раствора.
Концентрация компонента и концентрация
молекул этого компонента связаны между собой
простым соотношением:
СБ = NА.сБ.
По существу, это одна и та же величина – только,
если молекул много, то их подсчитывают в молях, а
если мало, то – в штуках.
Если в определенном объеме содержится не смесь,
а одно вещество (не обязательно химическое), то
для него тоже можно посчитать отношение числа
молекул (частиц) к занимаемому ими объему. Такая
величина называется концентрацией молекул
(частиц) данного вещества (не путать с "
концентрацией компонента" и с "
концентрацией молекул компонента" !); иногда ее
называют плотность молекул или плотность
частиц. Эта величина обычно обозначается
буквой n, и в тех случаях, когда она
используется, количество вещества обозначают
буквой n .
| Концентрация молекул (частиц) – отношение
числа молекул (частиц) вещества к объему, который
они равномерно заполняют. |
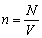
Так как " плотность молекул вещества Б" и
" концентрация компонента Б в смеси"
величины однородные, единицы измерений у них
одинаковые:
[n] = [СБ],
то есть эта величина также показывает, сколько
частиц содержится в единичном объеме.
В случае, когда частицами являются электроны,
плотность частиц (концентрация частиц)
называется электронной плотностью и
обозначается  е.
е.
 КОНЦЕНТРАЦИЯ
КОМПОНЕНТА, МОЛЯРНОСТЬ, КОНЦЕНТРАЦИЯ МОЛЕКУЛ
КОМПОНЕНТА, КОНЦЕНТРАЦИЯ МОЛЕКУЛ, ЭЛЕКТРОННАЯ
ПЛОТНОСТЬ
КОНЦЕНТРАЦИЯ
КОМПОНЕНТА, МОЛЯРНОСТЬ, КОНЦЕНТРАЦИЯ МОЛЕКУЛ
КОМПОНЕНТА, КОНЦЕНТРАЦИЯ МОЛЕКУЛ, ЭЛЕКТРОННАЯ
ПЛОТНОСТЬ
 1.Массовая доля хлорида натрия в водном растворе
равна 4 %. Определите массу хлорида натрия,
необходимого для приготовления 250 г этого
раствора.
1.Массовая доля хлорида натрия в водном растворе
равна 4 %. Определите массу хлорида натрия,
необходимого для приготовления 250 г этого
раствора.
2.Сколько нужно отвесить сульфата алюминия Al2(SO4)3
для приготовления 10 кг водного раствора этой
соли с массовой долей растворенного вещества,
равной 0,05?Ъ
3.Сколько можно получить нитрата калия KNO3,
если выпарить 30 м3 водного раствора с
массовой долей нитрата калия 10 %, учитывая, что
плотность такого раствора равна 1,06 г/мл?
4.В соответствии с данными таблицы составьте
условия задач и решите составленные вами задачи.
| Раствор |
Растворенное вещество
Б |
Массовая доля вещества Б,
wБ |
Объем раствора, Vp; мл |
Масса раствора,
mp; г |
Плотность раствора,  р(Б); г/см3 р(Б); г/см3 |
Масса растворенного вещества, mБ;
г |
Объем воды, V(H2O); л |
| 1 |
NaNO2 |
0,06 |
? |
-- |
1,04 |
100 |
-- |
| 2 |
CaCl2 |
0,15 |
-- |
37 |
-- |
? |
? |
| 3. |
H3PO4 |
0,6 |
? |
-- |
1,43 |
— |
1,5 |
| 4. |
HCl |
? |
100 |
-- |
1,10 |
22 |
-- |
| 5. |
NaOH |
? |
? |
250 |
1,15 |
35 |
-- |
5.В состав вещества входят водород,
углерод, кислород и азот в соотношении 1 : 3 : 4 : 7 по
массе. Определите массовые доли элементов в этом
веществе.
6.В соединении, содержащем углерод, кислород и
водород, массовая доля углерода равна 54,5 %, а
массовая доля кислорода – 36,34 %. Определите, в
каком отношении по массе (массовом отношении)
указанные элементы входят в состав вещества.
7.При изготовлении бронзы сплавили медь с оловом
в массовом отношении 5:1. Определите массовую долю
олова в этом сплаве.
8.В сплаве Вуда (tпл = 45oС) массовые
доли свинца, висмута, олова и ртути равны,
соответственно, 50; 25; 12,5 и 12,5 %, Определите, в каком
отношении по массе нужно взять компоненты для
приготовления этого сплава? Сколько ртути
содержится в 18 г этого сплава?
9.Массовая доля хлорида калия в водном растворе
равна 0,04. Определите концентрацию растворенного
вещества, если плотность раствора равна 1,01. г/мл.
10.Какова концентрация сульфата алюминия в
растворе, полученном по данным задачи 2?
Плотность раствора – 1,05 г/мл.
11.Какова концентрация нитрата калия в растворе,
фигурирующем в задаче 3? Плотность раствора – 1,06
г/мл.
12.Для растворов 1, 3, 4 и 5 (задача 4) определите
концентрацию растворенного вещества.
13.Определите массу хлорида калия, содержащегося
в а) 150 мл 0,1М раствора КCl в воде; 6) 50 мл 0,02М водного
раствора KCl; в) 2,5 л 0,015М водного раствора КС1.
14.Определите массу серной кислоты, необходимой
для приготовления 2 л ее 0,012М раствора в воде.
15.Рассчитайте массу воды и массу аммиака,
необходимых для приготовления 20 л 30 %-ного
раствора аммиака NH3 (плотность раствора –
0,92 г/мл).
16.Определите массовые доли компонентов в водных
растворах, представленных в таблице.
| Раствор |
Растворенное
вещество Б |
Концентрация
вещества Б, cБ; моль/л |
Плотность раствора,
 р(Б); г/см3 р(Б); г/см3
|
| 1. |
KOH |
5,0 |
1,20 |
2 |
HCl |
1,0 |
1,15 |
3 |
H2SO4 |
11,0 |
1,59 |
| 4 |
FeCl3 |
0,1 |
1,00 |
17.Определите концентрации компонентов в
следующих водных растворах: 26 %-ный раствор MgCl2
с плотностью 1,24 г/мл; б) 1 %-ный раствор AgNO3 с
плотностью 1,01 г/мл; в) 8 %-ный раствор BaCl2 с
плотностью 1,07 г/мл; г) 40 %-ный раствор BaCl2 с
плотностью 1,46 г/мл.
5.10. Определение химической формулы
вещества
Для установления формулы неизвестного
вещества химики проводят его анализ. Для этого
порцию вещества известной массы подвергают
определенным химическим превращениям, по
результатам которых узнают, какие элементы
входят в состав этого вещества. Проводя
различные измерения (чаще всего – взвешивания и
измерения объемов), определяют массовые доли
элементов в веществе. Эти данные анализа
позволяют установить простейшую формулу
вещества.
Задача
В соединении, содержащем углерод, водород и
кислород, массовая доля углерода равна 0,4865, а а
массовая доля водорода – 0,0811. Определите
простейшую формулу этого соединения.
Решение
Сначала найдем недостающее значение массовой
доли кислорода:
wO = 1 – (wC + wH)
= 1 – (0,4865 + 0,0811) = 0,4324.
Вспомним, что индексы в простейшей формуле
вещества CxHyOz,
показывают отношения чисел атомов элементов,
входящих в состав вещества: х : у : z = NC
: NH : NO или, учитывая, что N
= n.NA, x : y : z = nC
: nH : nO.
Количества вещества элементов соответственно
равны
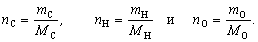
Молярные массы элементов нам известны, а массы
элементов можно выразить через их массовые доли:
mC = wC.m(CxHyOz);
mH = wH.m(CxHyOz)
и mO = wO.m(CxHyOz).
Так как состав вещества не зависит от его массы,
значение массы вещества можно взять любое ,
например, 1 грамм, тогда
mC = 1 г . 0,4865 = 0,4865 г;
mH = 1 г . 0,0811 = 0,0811 г;
mO = 1 г . 0,4324 = 0,4324 г.
MC = 12 г/моль, MH = 1 г/моль, MO
= 16 г/моль.
Таким образом
x : y : z = nC : nH
: nO =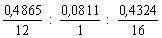 =
0,04054 : 0,0811 : 0,02703.
=
0,04054 : 0,0811 : 0,02703.
Чтобы получить отношение целых чисел, разделим
все три числа на наименьшее из них:
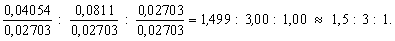
Умножив на 2, окончательно получим x : y : x
= 3 : 6 : 2.
Ответ: простейшая формула соединения – C3H6O2.
Для установления молекулярной формулы
вещества необходимо знать, во сколько раз его
молекулярная масса больше формульной массы,
вычисленной по простейшей формуле.
Например, молекулярную формулу бутана C4H10
мы можем записать как (C2H5)2, где
С2H5 – его простейшая формула. Отсюда
видно, что молекулярная масса бутана в 2 раза
больше формульной массы, рассчитанной для него
по простейшей формуле.
Для газообразных веществ источником информации
при определении молекулярной формулы служит
плотность или относительная плотность вещества,
так как:
М(Б) =  (Б).Vm
и М(Б) = МA.dA(Б).
(Б).Vm
и М(Б) = МA.dA(Б).
Задача
Определите молекулярную формулу вещества с
простейшей формулой SiH3, если относительная
плотность его паров по воздуху равна 2,14.
Решение
Запишем формулу вещества в виде (SiH3)z.
Тогда
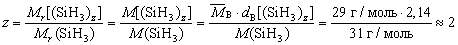 .
.
Ответ: молекулярная формула вещества Si2H6.
Аналогично определяется молекулярная формула
вещества с использованием значения плотности
пара этого вещества.
Зная химическую формулу вещества, вы всегда
можете определить
а) молекулярную (формульную) массу вещества;
б) молярную массу вещества;
в) массовую долю элемента в веществе;
г) мольную долю элемента в веществе.
 1.Установите
простейшие формулы оксидов железа, если массовые
доли железа и кислорода в них соответственно
равны а) 77,8 % и 22,2 %, б) 72,4 % и 27,6 %, в) 70,0 % и 30,0 %.
1.Установите
простейшие формулы оксидов железа, если массовые
доли железа и кислорода в них соответственно
равны а) 77,8 % и 22,2 %, б) 72,4 % и 27,6 %, в) 70,0 % и 30,0 %.
2.Установите простейшие формулы соединений,
содержащих марганец и кислород, если массовые
доли марганца в них составляют а) 0,775; б) 0,696; в) 0,632
и г) 0,495.
3.Установите молекулярные формулы газообразных
соединений углерода с водородом (углеводородов),
в которых массовые доли углерода составляют а)
0,800, б) 0,857. и в) 0,923. Плотности по водороду этих
газов равны а) 15, б) 14 и в) 13.
4.При сгорании чистого графита в кислороде
образовалась смесь монооксида и диоксида
углерода с плотностью по воздуху 1,24. Определите
состав газовой смеси в объемных долях.
5.При нормальных условиях (н. у.) плотность
газообразного вещества, в состав которого входят
азот и водород равна 0,759 г/л. Мольная доля
водорода в этом соединении равна 0,75. Найдите
молекулярную формулу вещества.
5.11. Расчеты по уравнениям химических
реакций
Запишем уравнение химической реакции в общем
виде:
aA + bB = dD + fF.
Здесь A, В, D и F – формулы веществ; а, b, d,
и f – коэффициенты в уравнении реакции.
Вы помните, что 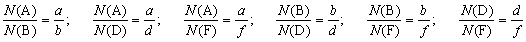 .
.
Но 
Следовательно 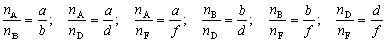
Таким образом, мы можем рассчитать количество
вещества любого реагента или продукта реакции,
если нам известно количество вещества любого
другого реагента или продукта.
Задача
Определите количество вещества хлора,
необходимого для получения 203,1 г трихлорида
железа FeCl3 из железа.
Решение
n(Cl2) = ? |
2Fe + 3Cl2 = 2FeCl3 |
m(FeCl3) = 203,1
M(FeCl3) = 162,5 г/моль |
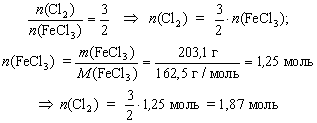 |
Ответ: n(Cl2) = 1,87 моль.
При проведении какого-либо химического
процесса по уравнению химической реакции мы
можем рассчитать количество вещества, а значит и
массу любого продукта реакции, но практически
столько продукта мы никогда не получим. В
реальном процессе всегда будут какие-нибудь
потери. Для определения количества вещества или
массы практически получаемого продукта реакции
нужно учитывать величину, называемую выходом
продукта реакции.
| Выход продукта реакции – отношение массы
реально полученного продукта реакции (mпракт)
к массе этого продукта, рассчитанной по
уравнению реакции (mтеор). |
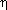 =
= 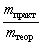
Выход продукта реакции – величина
безразмерная. Выражение для выхода продукта
реакции можно записать и так 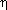 =
= 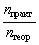
а для газообразных продуктов реакции еще и 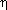 =
= 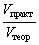
Докажите самостоятельно, что выход,
посчитанный любым из этих трех способов,
одинаков.
Вы, наверное, уже обратили внимание, что понятие
" выход продукта реакции" во многом сходно с
понятием " коэффициент полезного действия"
(и не только тем, что обозначается той же буквой).
Ведь вы знаете, что коэффициент полезного
действия системы определяется как отношение
энергии, использованной на совершение полезной
работы, к энергии, полученной системой, то есть
Коэффициент полезного действия системы, как и
выход продукта реакции, всегда меньше единицы.
Во многих реакциях выход хоть и меньше единицы,
но отличается от нее незначительно. В этих
случаях отличием выхода от единицы мы будем
пренебрегать, даже не оговаривая это специально.
Медь – Cu. Мягкий, ковкий металл красного
цвета, не реагирует с водой, очень хорошо
проводит тепло и электрический ток. Во влажном
воздухе покрывается светло-зеленым налетом
гидроксид-карбоната меди Cu2CO3(OH)2.
В сухом воздухе на поверхности меди образуется
пленка черного монооксида. В электротехнике
используют медь в чистом виде: в производстве
кабелей, электрогенераторов, телефонного и
телеграфного оборудования, радио- и электронной
аппаратуры. На улицах городов можно увидеть, как
красиво лучи солнца отражаются от крыш
отреставрированных зданий. Это долговечное
покрытие крыш – тоже сплав меди, со временем оно
приобретает благородный черный цвет. На основе
меди производят различные сплавы. Важнейшие из
них – латунь и бронза, они широко используются в
машиностроении и автомобилестроении. Беря в руки
столовые приборы из мельхиора и нейзильбера,
многие считают, что это сплавы серебра, а на самом
деле это сплавы меди с никелем и цинком. В
ювелирном деле используются не чистые золото и
серебро, а их сплавы с медью. Из медных сплавов
чеканят монеты.
Гептаоксид димарганца – Mn2O7. Это
один из немногих оксидов, жидких при комнатной
температуре. Темная маслянистая жидкость (в
отраженном свете зеленая, а в проходящем –
красная). Весьма гигроскопичен, термически очень
неустойчив, разлагается в обычных условиях со
взрывом. Крайне реакционноспособен. Будучи
кислотным оксидом, реагирует с водой и щелочами.
Монооксид углерода – CO. Газ без цвета и
запаха. Свое бытовое название (угарный газ) это
вещество получило благодаря тому, что именно
из-за него можно угореть в доме с печным
отоплением, если слишком рано закрыть заслонку
дымохода. Дело в том, что монооксид углерода,
также как и кислород, реагирует с гемоглобином
крови, но, в отличие от кислорода, образует с ним
устойчивое соединение – карбоксигемоглобин, при
этом гемоглобина для связывания с кислородом,
необходимым для дыхания, уже не остается. В воде
угарный газ растворяется плохо. В обычных
условиях он довольно инертен, но при повышении
температуры становится активным и может
реагировать со многими газами, например с NH3,
Cl2,, O2, металлами и некоторыми другими
веществами. Несмотря на свою ядовитость,
монооксид углерода находит применение в
промышленности – химическом синтезе и
металлургии. В смеси с водородом дает так
называемый "синтез-газ", из которого в
различных условиях можно получить множество
необходимых человеку веществ.
Серная кислота – H2SO4. Бесцветная
вязкая жидкость, охотно поглощающая влагу
(гигроскопична). в химии, а иногда и в быту, её даже
используют как водоотнимающее средство. При
разбавлении кислоты водой выделяется большое
количество теплоты, и раствор сильно
нагревается, поэтому при приливании кислоты к
воде (а делать это нужно только в такой
последовательности!) раствор необходимо
перемешивать. При нагревании она частично или
полностью (в зависимости от условий нагрева)
разлагается на воду и триоксид серы. Серная
кислота применяется при производстве удобрений,
пластмасс, красителей, лекарств, бумаги,
взрывчатых веществ, в металлургии – для очистки
металлов. Кроме того, ее используют для
составления нитрующих смесей с азотной кислотой,
для реакций сульфирования (в органическом
синтезе), для очистки нефтепродуктов и
минеральных масел, а также для наполнения
свинцовых аккумуляторов. Серная кислота и ее
концентрированные растворы разрушающе
действуют на органические вещества – обугливает
их. Если при работе с серной кислотой ощущается
пощипывание или жжение – значит, кислота попала
на кожу и необходимо ее смыть большим
количеством проточной воды, смочить место ожога
раствором соды и снова промыть водой.
Аммиак – NH3. Бесцветный газ, с
характерным резким запахом, легче воздуха. При
избыточном давлении или охлаждении он легко
сжижается, образуя бесцветную жидкость, при
более низкой температуре он переходит в твердое
состояние – вещество белого цвета. Аммиак очень
хорошо растворяется в воде (до 700 объемов газа в
одном объеме воды при нормальных условиях), при
этом он частично реагирует с ней. Раствор аммиака
в воде называют нашатырным спиртом, если его
концентрация колеблется в пределах от 3 до 10 %,
более концентрированные растворы (18 – 25 %)
называют аммиачной водой. Аммиак весьма
реакционноспособен, он реагирует с самыми
разнообразными веществами. В промышленности
аммиак получают прямым синтезом из азота и
водорода. В лабораторных условиях его можно
получить, нагревая хлорид аммония с гашеной
известью. Используется аммиак в качестве
хладагента (рабочего вещества различных
холодильных машин), в производстве азотной
кислоты, органических продуктов и жидких
удобрений, а также соды. |
 ВЫХОД
ПРОДУКТА РЕАКЦИИ
ВЫХОД
ПРОДУКТА РЕАКЦИИ
 1.Разделите изученные в этой главе физические
величины на группы однородных величин.
1.Разделите изученные в этой главе физические
величины на группы однородных величин.
2.Определите количество вещества углекислого
газа, образующегося при сгорании 6 г графита.
3.В промышленности негашеную известь (оксид
кальция СаО) получают, прокаливая известняк
(карбонат кальция CaCO3), при этом кроме
оксида кальция образуется углекислый газ.
Определите объем этого газа (н. у.), выделившегося
при прокаливании 1,5 т известняка.
4.В промышленности HCl получают, сжигая хлор в
водороде. Определите массу водорода,
необходимого для реакции со 125 м3 хлора (н.
у.). Каково количество вещества образовавшегося
HCl?
5.При взаимодействии цинка с соляной кислотой
(раствором HCl в воде) протекает реакция.
Zn + 2НСl = ZnCl2 + H2 .
Для получения по этой реакции хлорида цинка в 1,6
л 0,5М соляной кислоты поместили 30 г цинка. После
прекращения выделения водорода оказалось, что
цинк прореагировал не полностью. Определите
массу оставшегося непрореагировавшим цинка.
6.Определите объем водорода (н. у.), выделившегося
при взаимодействии избытка алюминия с серной
кислотой, содержавшейся в 200 мл ее водного
раствора с массовой долей кислоты 10 % и
плотностью раствора 1,07 г/см3. Каково
минимальное количество вещества алюминия,
необходимого для полного использования
имеющейся серной кислоты? Схема протекающей
реакции:
Al + Н2SO4  Al2(SO4)3
+ H2 .
Al2(SO4)3
+ H2 .
7.При взаимодействии водорода с кислородом
образуется вода (иногда со взрывом). Смешали 5 л
водорода и 4 л кислорода (н. у. ). Смесь подожгли и
после завершения реакции снова привели к
нормальным условиям. Определите состав и объем
оставшегося газа.
8.Каков объем водорода (н. у.), получившегося при
взаимодействии 15 г алюминия с соляной кислотой,
содержащей 15 г HCl?
9.Определите массу йодида алюминия AlI3,
образовавшегося при взаимодействии алюминия
массой 3 грамма с йодом той же массы.
10.При взаимодействии 5 г оксида фосфора P4O10
со 100 г воды образовался раствор фосфорной
кислоты в воде. Определите массовую долю
фосфорной кислоты в этом растворе.
11.При сжигании 3,2 г серы в кислороде получилось 6 г
SO2. Определите выход в реакции.
12.При взаимодействии 200 л CO2 с раскаленным
графитом образовалось 380 л монооксида углерода.
Объемы газов измерены при одинаковых условиях.
Определите выход монооксида.
13.Один из этапов производства серной кислоты
состоит во взаимодействии диоксида серы с
кислородом с образованием триоксида серы. Выход
триоксида серы – 95%. Определите массу диоксида
серы, необходимого для получения 2 т триоксида
серы. Каков объем затраченного для этого
кислорода (н. у.)?
14.При выплавке чугуна в доменной печи протекает
реакция
Fe2O3 + 3СО = 2Fe + 3CO2.
Сколько железа можно получить из 100 т железной
руды с массовой долей не содержащих железо
примесей, равной 20 %? (Примечание. Вопрос "
сколько железа...?" задан неточно. На него можно
ответить по-разному: определив количество
вещества, массу или даже объем железа, если
известна его плотность. Обычно в таких случаях в
ответе дается значение той физической величины,
которая приведена для другого вещества в условии
задачи.)
15.Условие задачи 14. Вместо руды использован
чистый Fe2O3, но выход железа – 90 %.
16.Условие задачи 14. Вместо руды использован оксид
железа FeO, содержащий 15 % (по массе) диоксида
кремния.
17.Условие задачи 14, но выход железа – 90 %.
18.Сколько медной руды, представляющей собой
сульфид меди CuS и содержащей 25 % примесей,
необходимо переработать, чтобы получившейся
меди хватило для выплавки 100 кг бронзы, в состав
которой кроме меди входит 10 % олова, если выход
меди по реакции получения ее из сульфида
составляет 90 %?

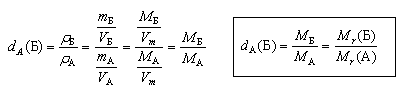
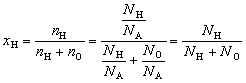 .
.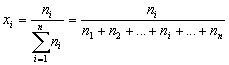
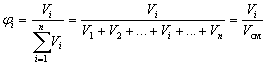
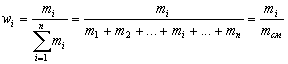
 =
= 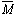 =
=