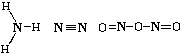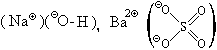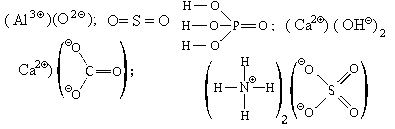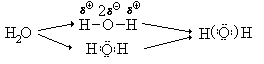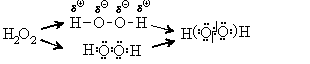С. Т. Жуков Химия 8-9 класс
7.15. Валентность
Познакомившись с разными типами химической
связи, мы можем теперь уточнить одно из ключевых
понятий химии - понятие " валентность" .
Это понятие используется для количественной
характеристики способности атома соединяться с
определенным числом других атомов.
| Валентность (W) - число
химических связей, образуемых атомом. |
Понятие " валентность" имеет смысл только
для двух типов химической связи: ионной и
ковалентной.В случае ковалентной связи
используется понятие ковалентность.
| Ковалентность (Wк) - число
ковалентных связей, образованных атомом. |
Ковалентность атома равна числу электронных
пар, связывающих атом с другими атомами молекулы
или кристалла.В случае ионной связи используется
понятие электровалентность.
| Электровалентность (Wэ) -
абсолютная величина формального заряда атома. |
Если атом образует одну связь, то его называют одновалентным,
если две связи - двухвалентным, и так далее.
ВНИМАНИЕ!
В настоящее время очень часто ковалентность
называют просто валентностью, игнорируя
существование электровалентности. |
Валентность атома определяется как
сумма электровалентности и ковалентности: W
= Wэ + Wк
Если известно химическое строение вещества, то
валентность каждого из атомов можно просто
посчитать по структурной формуле, например:
1) NaCl, (Nа )
(Cl
)
(Cl ) Wэ(Nа)
= 1, Wк (Nа) = 0, W(Nа) = 1 Wэ(Cl) = 1, Wк(Cl)
= 0, W(Cl) = 1
) Wэ(Nа)
= 1, Wк (Nа) = 0, W(Nа) = 1 Wэ(Cl) = 1, Wк(Cl)
= 0, W(Cl) = 1
2) НCl, Н -Cl Wэ(Н) = 0, Wк(Н) = 1, W(H)
= 1 Wэ(Cl) = 0, Wк(Cl) = 1, W(Cl) = 1
3) CaCl2, (Ca2 )(Cl
)(Cl )2 Wэ(Ca) = 2, Wк(Ca)
= 0, W(Ca) = 2 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl)
= 1
)2 Wэ(Ca) = 2, Wк(Ca)
= 0, W(Ca) = 2 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl)
= 1
4) CH4, 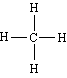 Wэ(C) = 0, Wк(C) =
4, W(C) = 4 Wэ(H) = 0, Wк(H) = 1, W(H)
= 1
Wэ(C) = 0, Wк(C) =
4, W(C) = 4 Wэ(H) = 0, Wк(H) = 1, W(H)
= 1
5) NH4Cl, 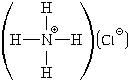 Wэ(H) = 0, Wк(H) =
1, W(H) = 1 Wэ(N) = 1, Wк(N) = 4, W(N)
= 5 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1
Wэ(H) = 0, Wк(H) =
1, W(H) = 1 Wэ(N) = 1, Wк(N) = 4, W(N)
= 5 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1
6) CO2, O=C=O Wэ(C) = 0, Wк(C)
= 4, W(C) = 4 Wэ(O) = 0, Wк(O) = 2, W(O)
= 2
7) (H3O)2SO4, 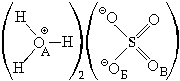 Wэ(H) = 0, Wк(H)
= 1, W(H) = 1 Wэ(OА) = 1, Wк(OА)
= 3, W(OА) = 4, Wэ(OБ) = 1, Wк(OБ)
= 1, W(OБ) = 2 Wэ(OВ) = 0, Wк(OВ)
= 2, W(OВ) = 2 Wэ(S) = 0, Wк(S) =
6, W(S) = 6
Wэ(H) = 0, Wк(H)
= 1, W(H) = 1 Wэ(OА) = 1, Wк(OА)
= 3, W(OА) = 4, Wэ(OБ) = 1, Wк(OБ)
= 1, W(OБ) = 2 Wэ(OВ) = 0, Wк(OВ)
= 2, W(OВ) = 2 Wэ(S) = 0, Wк(S) =
6, W(S) = 6
- Можно ли, зная только валентности атомов,
входящих в состав вещества, составить
структурную формулу этого вещества?
- Нет, нельзя! Например, зная, что Wк(O) = 2,
а Wк(H) = 1, можно составить сколько угодно
структурных формул соединений кислорода с
водородом: H-О-Н, Н-О-О-Н, Н-О- О-О-Н и т.д.
Формально все эти структурные формулы
правильные, но реально существующим соединениям
соответствуют только первые две из них.
Чтобы составить структурную формулу вещества,
нужно прежде всего знать:
1) тип структуры (молекулярный или
немолекулярный);
2) простейшую или молекулярную формулу;
3) тип химических связей (ионные или ковалентные);
4) валентности атомов.
Для простейших соединений этого достаточно, а
для более сложных потребуется дополнительная
информация (химическая).
Попробуем составить структурную формулу
сернистого газа. Это молекулярное вещество с
молекулярной формулой SO2. Связи в молекуле
ковалентные. Wк(S) = 4, Wк(O) = 2. По
этим данным можно составить единственную
структурную формулу: O=S=O.
Составим теперь структурную формулу серной
кислоты. Это тоже молекулярное вещество.
Молекулярная формула H2SO4. Связи в
молекуле ковалентные. Wк(H) = 1, Wк(S)
= 6, Wк(O) = 2. В этом случае по имеющимся
данным можно составить пять " правильных"
структурных формул:
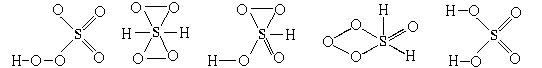
Чтобы выбрать из них действительно правильную,
нам придется вспомнить, что серная кислота -
гидроксид, а из этого следует, что все атомы
водорода в ее молекуле связаны с атомами
кислорода. Отсюда правильная структурная
формула серной кислоты: 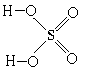
Для соединений, в которых атомы связаны только
ионными связями, структурные формулы составляют,
используя заряды ионов, например:
(Na )(Cl
)(Cl ); (Ca2
); (Ca2 )(Br
)(Br )2; (K
)2; (K )2(S2
)2(S2 ) и т. д.
) и т. д.
А как определить, какую валентность атом может
проявлять, соединяясь с другими атомами, то есть
как охарактеризовать его валентные возможности?
Для этого прежде всего вспомним, что должно быть
у атома, чтобы он мог образовать химические
связи. Это может быть
1) электрический заряд;
2) неспаренный валентный электрон;
3) неподеленная пара валентных электронов;
4) свободная валентная орбиталь.
Все это вместе взятое и определяет валентные
возможности атома каждого из элементов. При этом
надо помнить, что прежде всего реализуются
валентные возможности, определяемые зарядом и
наличием неспаренных электронов как в основном,
так и в возбужденном состоянии (основные
валентные возможности), а уж затем - определяемые
наличием у атома неподеленных электронных пар и
свободных валентных орбиталей (дополнительные
валентные возможности).
Валентные возможности зависят от того, в каком
валентном состоянии находится атом.
| Валентное состояние - состояние
электронной оболочки атома перед образованием
связи. |
К валентным состояниям относятся основное,
возбужденные и ионизированные состояния атома.
Таблица 24. Основные валентные
возможности атомов первых 10 элементов в
разных валентных состояниях
Символ
элемента |
Диаграмма
валентных подуровней атома |
Валентность |
Примеры
веществ и примечания |
Wэ |
Wк |
H |
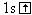 |
0 |
1 |
Н-- Н,
Н--О--Н, Н--С1 |
H |
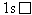 |
1 |
0 |
Соединений
не существует. |
H |
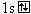 |
1 |
0 |
(Na )(H )(H ), (Ca2 ), (Ca2 )(H )(H )2 )2 |
He |
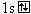 |
0 |
0 |
Соединений
не существует |
Li |
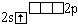 |
0 |
1 |
Li- Li,
молекула очень неустойчива |
Li* |
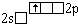 |
0 |
1 |
Дополнительного
выигрыша в энергии нет. 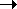 Затраты на возбуждение не
компенсируются. Затраты на возбуждение не
компенсируются. 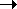 Состояние не реализуется. Состояние не реализуется. |
Li |
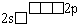 |
1 |
0 |
(Li )(H )(H ), (Li ), (Li )(Cl )(Cl ), (Li ), (Li )2(O2 )2(O2 ), (Li ), (Li )( )( O- H) O- H) |
Be |
 |
0 |
0 |
- |
Be* |
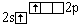 |
0 |
2 |
Cl- Be- Cl Энергия,
затраченная на возбуждение, компенсируется
образованием двух ковалентных связей. |
Be2 |
 |
2 |
0 |
Склонность к отдаче
электронов низкая. Состояние не реализуется. |
В |
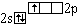 |
0 |
1 |
- |
Образование трех
ковалентных связей дает выигрыш в энергии,
превышающий затраты на возбуждение. |
B* |
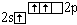 |
0 |
3 |
Cl --Be -- Cl |
B3 |
 |
3 |
0 |
Склонностью
к отдаче электронов не обладает.Состояние не
реализуется. |
C |
 |
0 |
2 |
Устойчивых
веществ не образует. |
C* |
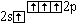 |
0 |
4 |
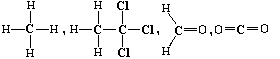
|
N |
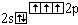 |
0 |
3 |
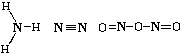
|
N3 |
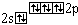 |
3 |
0 |
(Li )3(N3 )3(N3 ), (Mg2 ), (Mg2 )3(N3 )3(N3 )2 )2 |
O |
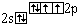 |
0 |
2 |
H- O- H, O=C=O, H-
O- N=O |
O2 |
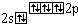 |
2 |
0 |
(Na )2(O2 )2(O2 ), (Ca2 ), (Ca2 )(O2 )(O2 ), (Al3 ), (Al3 )2(O2 )2(O2 )3 )3 |
O |
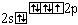 |
1 |
1 |
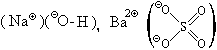
|
F |
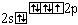 |
0 |
1 |
F- F, H- F, F- O- F |
F |
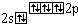 |
1 |
0 |
(Na )(F )(F ), (Ca2 ), (Ca2 )(F )(F )2 )2 |
Ne |
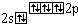 |
0 |
0 |
Соединений
не существует. |
Аналогично можно проанализировать основные
валентные возможности атомов других элементов.
Дополнительные валентные возможности
проявляются атомами при образовании связей по
донорно-акцепторному механизму. Причем атомы
прежде всего реализуют свои основные валентные
возможности и только после этого при наличии
соответствующих условий - дополнительные
валентные возможности. Как проявляются
дополнительные валентные возможности атомов
бора, азота и кислорода, вы уже знаете (см.
параграф 7.12). С дополнительными валентными
возможностями других атомов вы познакомитесь
позже.
Хлороводород - HCl. Бесцветный
газ с резким неприятным запахом. Сухой
хлороводород - устойчивое и малоактивное
соединение. Большую часть этого вещества не
получают специально, а выделяют из промышленных
газов, где оно скапливается в качестве побочного
продукта разнообразных химических производств;
не утратил своего значения и прямой синтез
хлороводорода из простых веществ. Почти весь
хлороводород расходуется на производство соляной
(хлороводородной) кислоты - раствора
хлороводорода в воде.
Максимальная массовая доля хлороводорода
соляной кислоте зависит от температуры и
давления (при комнатной температуре и
атмосферном давлении она равна примерно 40 %).
Соляная кислота - один из самых разрушительных
реагентов для большинства металлов. В очень
разбавленном виде соляная кислота присутствует
в желудке человека и участвует в пищеварении.
Используется соляная кислота для очистки
поверхности металлов, в производстве лекарств,
разнообразных хлоридов, уксусной кислоты,
органических красителей, пластмасс и во многих
других отраслях промышленности. |
 ВАЛЕНТНОСТЬ,
КОВАЛЕНТНОСТЬ, ЭЛЕКТРОВАЛЕНТНОСТЬ, ВАЛЕНТНОЕ
СОСТОЯНИЕ, ОСНОВНЫЕ ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ,
ДОПОЛНИТЕЛЬНЫЕ ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ.
ВАЛЕНТНОСТЬ,
КОВАЛЕНТНОСТЬ, ЭЛЕКТРОВАЛЕНТНОСТЬ, ВАЛЕНТНОЕ
СОСТОЯНИЕ, ОСНОВНЫЕ ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ,
ДОПОЛНИТЕЛЬНЫЕ ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ.
 1.Определите
электровалентность, ковалентность и общую
валентность атомов в следующих веществах:
1.Определите
электровалентность, ковалентность и общую
валентность атомов в следующих веществах:
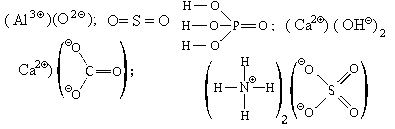
Запишите для молекулярных веществ
молекулярные формулы, а для немолекулярных -
простейшие. Назовите эти вещества.
2.Составьте структурные формулы следующих
соединений:
а) триоксид серы SO3 [молекулярное вещество, Wк(S)
= 6];
б) сернистая кислота H2SO3
[молекулярное вещество, Wк(S) = 4];
в) гидроксид бария Ba(OH)2 [немолекулярное
вещество, ионный кристалл, в анионе связь
ковалентная, W(O) = 2, Wэ(Ba) = 2, Wк(H)
= 1];
г) сульфат марганца MnSO4 [немолекулярное
вещество, ионный кристалл, в анионе связь
ковалентная, Wэ(Mn) = 2, Wк(S) = 6, W(O)
= 2].
3.Охарактеризуйте основные валентные
возможности атомов следующих элементов: Na, Ca, Se, Br.
Приведите примеры простейших соединений этих
элементов. Составьте молекулярные (или
простейшие) и структурные формулы этих веществ;
назовите их.
7.16. Степень окисления
При химических реакциях происходит разрыв
одних и образование других химических связей.
Валентные электроны при этом часто переходят от
одного атома к другому. Это происходит, например,
при образовании хлорида натрия по реакции натрия
с хлором:
2Nа + Cl2 = 2NaCl.
На одном из этапов этой реакции атомы натрия
отдают электроны, а атомы хлора их принимают, то
есть происходит переход электронов от атомов
натрия к атомам хлора с образованием ионов:
Na - 1е- = Na ;
;
Cl + 1е- = Cl .
.
Эти процессы носят названия " окисление" и
" восстановление" .
Окисление - процесс, при котором атомы теряют
электроны.
Восстановление - процесс, при котором атомы
принимают электроны.
Натрий при образовании хлорида натрия окисляется
(теряет электроны), а хлор восстанавливается (принимает
электроны). При этом хлор является окислителем,
а натрий - восстановителем.
Но не всегда электроны при химических реакциях
полностью переходят от одного атома к другому.
Например, при образовании воды из водорода и
кислорода
2H2 + O2 = 2Н2О
электроны образующейся полярной ковалентной
связи Н- O лишь частично переходят от атомов
водорода к атомам кислорода.
Для характеристики состояния атома после полной
или частичной потери одного или нескольких
электронов или их приобретения используется
величина, называемая степенью окисления (С/О).
Можно дать два определения этой величины.
Степень окисления атома:
1) тот заряд, который приобрел бы атом в молекуле
(в кристалле), если бы все связи в ней (в нем) стали
ионными;
2) тот заряд, который приобрел бы атом в молекуле
(в кристалле), если бы все электронные пары
полярных ковалентных связей полностью сместить
в сторону более электроотрицательных атомов, а
электронные пары неполярных связей поделить
между связываемыми атомами пополам. |
Итак, степень окисления - это условный заряд
атома (условие - в определении).
Степень окисления обозначается римскими цифрами
со знаком перед ними: +I, - II, +VIII, - III и так далее.
Определим степени окисления атомов в молекуле
воды. При этом для указания, к какому из атомов мы
в соответствии с определением полностью сместим
электроны, будем использовать круглые скобки:
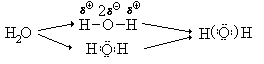
У изолированного атома кислорода было 6
валентных электронов, стало 8 валентных
электронов, следовательно, степень окисления
кислорода 6 - 8 = - II.
У изолированного атома водорода был 1 валентный
электрон, стало 0 валентных электронов,
следовательно степень окисления атома водорода 1
- 0 = +I.
Точно так же можно определить степени окисления
атомов в молекуле пероксида водорода H2O2,
но здесь электроны неполярной связи О-O нужно
разделить между атомами кислорода:
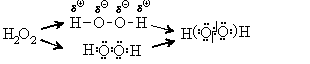
| О: |
было 6е- |
Н: |
был 1е- |
| |
стало 7е- |
|
стало 0е- |
| |
С/О(О) - I |
|
С/О(Н) +I |
Другие примеры:
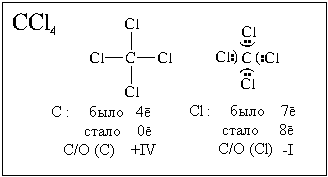
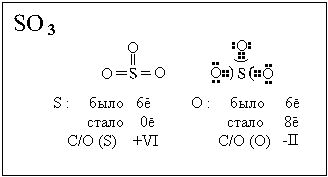
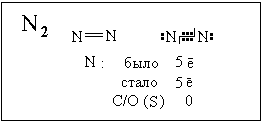
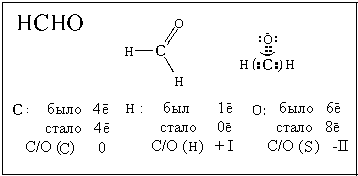
В бинарных ионных соединениях все связи между
атомами ионные, и, следовательно, степени
окисления атомов равны зарядам их простых ионов.
Высшая степень окисления атома
элемента равна номеру группы, в которой
находятся данный элемент в системе элементов.
Это следует из того, что атом может отдать
(полностью или частично) только свои валентные
электроны, а их число у него как раз и равно
номеру группы. Так, высшая степень окисления
калия равна +I, алюминия +III, углерода +IV, хлора +VII и
так далее.
Низшая степень окисления атома
элемента равна номеру группы минус 8 и не может
быть по абсолютной величине больше четырех. Это
связано с тем, что атом может принимать электроны
(полностью или частично) только на валентные
подуровни, стремясь дополнить свою электронную
конфигурацию до конфигурации благородного газа.
Так, низшая степень окисления азота равна - III,
кислорода - II, хлора - I и так далее.
Зная степени окисления атомов и помня о
электронейтральности веществ, легко составлять
простейшие формулы соединений, даже не зная,
каков в них характер химических связей
(ограничение: все атомы каждого из элементов
должны быть в одной и той же степени окисления).
Примеры:
1) Na и О: Na+I O-II  Na2O;
Na2O;
2) Р и С1: Р+V С1- I 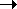 PCl5;
PCl5;
3) Cl и О: Cl+VII O- II 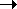 Cl2O7;
Cl2O7;
4) Н и S: Н+I S- II 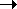 H2S;
H2S;
5) Н и Ca: H- I Ca+II 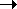 CaH2.
CaH2.
Если в сложном веществе известны степени
окисления атомов всех элементов кроме одного, то,
зная формулу этого соединения (простейшую или
молекулярную), можно определить степень
окисления атомов и последнего из элементов.
Примеры:
1) Fe+IIS2 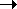 S- I
S- I
2) Al2O- II3 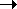 Al+III
Al+III
3) Be+II2C 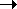 C- IV
C- IV
4) H+I3AsO- II4 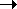 As+V
As+V
5) CO- IICl+II2 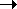 C+IV
C+IV
6) K+I2Cr2O- II7 Ю Cr+VI
Обозначение степени окисления атома при
символе элемента занимает место правого
верхнего индекса, но в формуле сложного вещества
- может ставиться и над символом
соответствующего элемента.
Уметь определять степень окисления атома в
сложном веществе особенно важно в тех случаях,
когда атомы элементов могут иметь несколько
степеней окисления, например:
H+I2S 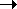 S- II; SO- II2
S- II; SO- II2
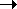 S+IV;
SO- II3
S+IV;
SO- II3 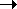 S+VI.
S+VI.
Если в аналогичных соединениях атомы одного
элемента имеют разную степень окисления, то ее
обозначение используется в названиях этих
сложных веществ (более подробно об этом в
следующей главе):
Fe2O3 - оксид железа(III) и FeO - оксид
железа(II);
PCl3 - хлорид фосфора(III) и PCl5 - хлорид
фосфора(V).
В этом случае знак " +" в обозначении
степени окисления не ставится.
| Оксид-дихлорид углерода СCl2О,
обычно называемый фосгеном, представляет
собой бесцветный крайне ядовитый газ тяжелее
воздуха. Он относится к группе боевых
отравляющих веществ удушающего действия,
использование его как химического оружия
запрещено. Тем не менее, фосген производится
химической промышленностью многих стран как
сырье для производства других химических
веществ. Пероксид водорода H2O2
(старое название - перекись водорода). Чистый
пероксид водорода - бесцветная вязкая жидкость,
иногда взрывающаяся без видимых причин.
Температура плавления 0 oС, температура
кипения 152 oС. С водой пероксид водорода
смешивается во всех отношениях.Водные растворы
пероксида водорода более устойчивы, но на свету
это вещество медленно разлагается на воду и
кислород даже в растворе. Пероксид водорода
значительно более реакционноспособен, чем вода,
что связано с наличием в его молекуле слабых
связей O- O. Применяется в лабораторной практике и
промышленности. В медицине используется как
кровоостанавливающее и антисептическое
средство (каждый минимальный аптечный набор
должен содержать пузырек с " перекисью" ).
Благодаря своим отбеливающим свойствам, Н2О2
входит в состав некоторых жидких отбеливателей. |
 ОКИСЛЕНИЕ,
ВОССТАНОВЛЕНИЕ, ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ,
СТЕПЕНЬ ОКИСЛЕНИЯ.
ОКИСЛЕНИЕ,
ВОССТАНОВЛЕНИЕ, ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ,
СТЕПЕНЬ ОКИСЛЕНИЯ.
 1.Составьте
структурные формулы следующих молекулярных
веществ:
1.Составьте
структурные формулы следующих молекулярных
веществ:
а) SO3, Wк(S) = 6; б) SCl2O, Wк(S) =
4; в) N2O3, Wк(N) = 3; г) H2S2O7,
Wк(S) = 6; д) H2CrO4, Wк(Cr)
= 6; е) H3BO3, Wк(B) = 3. Определите
степени окисления атомов, входящих в состав
каждого из этих соединений.
2.Определите степени окисления атомов :
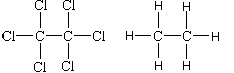
а) углерода в гексахлорэтане и этане
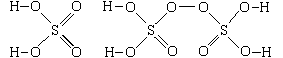
б) серы и кислорода в тиосерной и
пероксодисерной кислотах
в) натрия и кислорода в оксиде и пероксиде
натрия;
г) хлора и кальция в хлориде кальция.
3.Определите высшую и низшую степени окисления
атомов элементов третьего периода. Приведите
примеры соединений.
4.Составьте простейшие формулы оксидов азота, в
которых степени окисления азота а) +I, б) +II, в) +III, г)
+IV, д) +V и назовите эти оксиды. Как вы думаете, для
каких из этих оксидов простейшая формула может
не совпадать с молекулярной?
5.Составьте простейшие формулы оксидов марганца
со степенью окисления а) +II, б) +III, в) +IV, г) +VII и
назовите эти оксиды. Как вы думаете, каков тип
связи в каждом из этих оксидов?
6.Используя обозначения степеней окисления,
назовите соединения: а) СО и CO2; б) SiO и SiO2;
в) SF4 и SF6; г) CrCl2 и CrCl3; д) CuBr
и CuBr2.
 1.
Составление шаростержневых моделей молекул.
1.
Составление шаростержневых моделей молекул.
2. Простейшие окислительно-восстановительные
реакции.

 Wэ(C) = 0, Wк(C) =
4, W(C) = 4 Wэ(H) = 0, Wк(H) = 1, W(H)
= 1
Wэ(C) = 0, Wк(C) =
4, W(C) = 4 Wэ(H) = 0, Wк(H) = 1, W(H)
= 1 Wэ(H) = 0, Wк(H) =
1, W(H) = 1 Wэ(N) = 1, Wк(N) = 4, W(N)
= 5 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1
Wэ(H) = 0, Wк(H) =
1, W(H) = 1 Wэ(N) = 1, Wк(N) = 4, W(N)
= 5 Wэ(Cl) = 1, Wк(Cl) = 0, W(Cl) = 1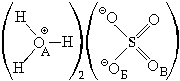 Wэ(H) = 0, Wк(H)
= 1, W(H) = 1 Wэ(OА) = 1, Wк(OА)
= 3, W(OА) = 4, Wэ(OБ) = 1, Wк(OБ)
= 1, W(OБ) = 2 Wэ(OВ) = 0, Wк(OВ)
= 2, W(OВ) = 2 Wэ(S) = 0, Wк(S) =
6, W(S) = 6
Wэ(H) = 0, Wк(H)
= 1, W(H) = 1 Wэ(OА) = 1, Wк(OА)
= 3, W(OА) = 4, Wэ(OБ) = 1, Wк(OБ)
= 1, W(OБ) = 2 Wэ(OВ) = 0, Wк(OВ)
= 2, W(OВ) = 2 Wэ(S) = 0, Wк(S) =
6, W(S) = 6