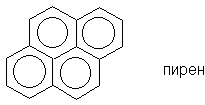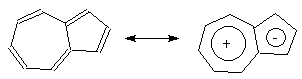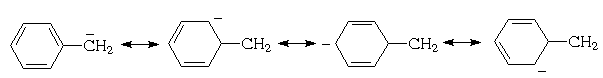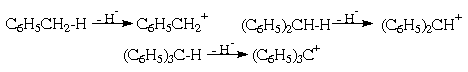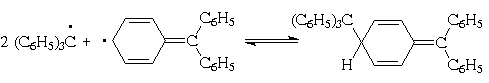|
Зык Н.В., Белоглазкина Е.К."Ароматичность и ароматические углеводороды"/ Органическая химия
II.3. Конденсированные
ароматические углеводороды
Правило Хюккеля об ароматичности (4n+2)  -электронной системы выведено для
моноциклических систем. На полициклические
конденсированные (т.е. содержащие несколько
бензольных колец с общими вершинами) системы оно
может быть перенесено для систем, имеющих атомы,
общие для двух циклов, например, для
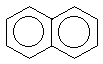
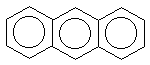
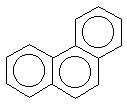
показанных ниже нафталина, антрацена,
фенантрена, бифенилена:(прим.12) -электронной системы выведено для
моноциклических систем. На полициклические
конденсированные (т.е. содержащие несколько
бензольных колец с общими вершинами) системы оно
может быть перенесено для систем, имеющих атомы,
общие для двух циклов, например, для
показанных ниже нафталина, антрацена,
фенантрена, бифенилена:(прим.12)
|
|
|
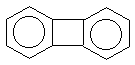
|
нафталин |
фенантрен |
антрацен |
бифенилен |
Для соединений, имеющих хотя бы один атом, общий
для трех циклов (например для пирена), правило
Хюккеля неприменимо.
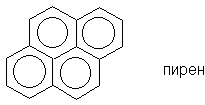
Бициклические аннулены - нафталин или азулен
являются электронными аналогами [10]-аннуленов с
десятью  -электронами
(см.раздел ii.2). Оба этих соединения обладают
ароматическими свойствами, но нафталин
бесцветен, а азулен окрашен в темно-синий цвет,
поскольку в его строение существенный вклад
вносит биполярная структура, представляющая
собой сочетание ядер циклопентадиенил-аниона и
катиона тропилия: -электронами
(см.раздел ii.2). Оба этих соединения обладают
ароматическими свойствами, но нафталин
бесцветен, а азулен окрашен в темно-синий цвет,
поскольку в его строение существенный вклад
вносит биполярная структура, представляющая
собой сочетание ядер циклопентадиенил-аниона и
катиона тропилия:
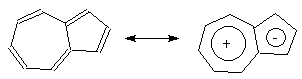
азулен
Реакционная способность конденсированных
ароматических углеводородов несколько повышена
по сравнению с моноциклическими аренами: они
легче окисляются и восстанавливаются, вступают в
реакции присоединения и замещения. О причинах
такого различия в реакционной способности см.
раздел II.5.
II.4. Углеводороды с изолированными бензольными
ядрами. Трифенилметаны.
Из углеводородов с изолированными
бензольными ядрами наибольший интерес
представляют ди- и три-фенилметаны, а также
бифенил.(прим.13) Свойства
бензольных ядер в ди-и трифенилметанах такие же,
как и в обычных алкилбензолах. Особенности их
химического поведения проявляются в свойствах
С-Н связи алифатической ("метановой") части
молеулы. Легкость гетеро- или гомолитического
разрыва этой связи зависит прежде всего от
возможности делокализации возникающего
положительного или отрицательного заряда (в
случае гетеролитического разрыва) или
неспаренности электрона (в случае
гомолитического разрыва). В ди- и особенно в
три-фенилметановой системе возможность такой
делокализации исключительно велика.
Рассмотрим вначале способность фенилированных
метанов к диссоциации С-Н связи с отщеплением
протона ( СН-кислотность ).
Сила СН-кислот, как и обычных протонных ОН-кислот,
определяется устойчивостью, а следовательно и
легкостью образования, соответствующих анионов
(в рассматриваемом случае - карбанионов).
Устойчивость и легкость образования анионов, в
свою очередь, определяются возможностью
делокализации в них отрицательного заряда.
Каждое бензольное ядро, связанное с бензильным
атомом углерода, может принимать участие в
делокализации возникающего на нем
отрицательного заряда, что можно представить с
помощью граничных (резонансных) структур:
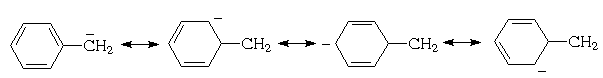
Для дифенилметана можно изобразить уже семь
граничных структур:
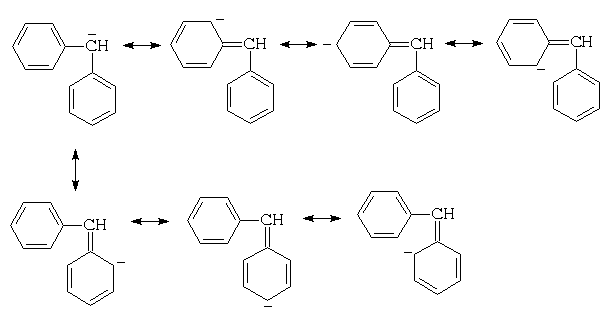
а для трифенилметана - десять:
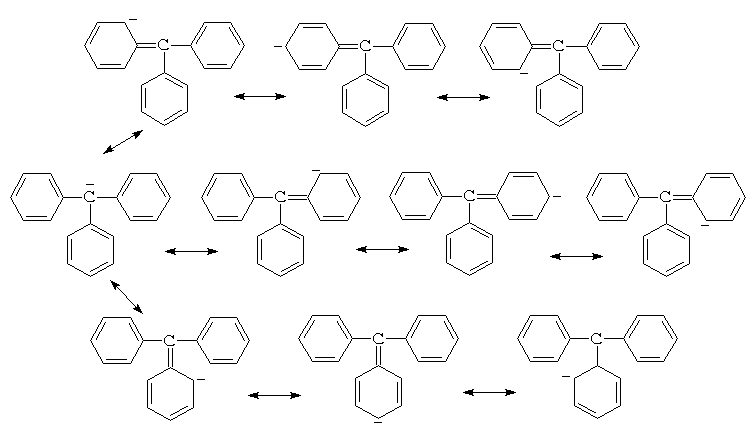
Поскольку с числом возможных граничных
структур растет способность к делокализации, ди-
и особенно трифенилметил-анионы должны обладать
особой устойчивостью.(прим.14) В
связи с этим можно ожидать, что СН-кислотность
метанов будет увеличиваться с увеличением числа
фенильных колец, которые могут принимать участие
в делокализации заряда на центральном атоме
углерода, т.е. возрастать в ряду
СН4 < С6Н5СН3 <
(С6Н5)2СН2 < (С6Н5)3СН
Значения pKa указанных углеводородов,
определенные специальными методами,
подтверждают это предположение. Дифенилметан (pKa
33) по кислотности приблизительно равен аммиаку, а
трифенилметан (pKa 31.5) - трет-бутанолу;
трифенилметан более чем в 1010 раз кислее
метана (pKa~ 40).(прим.15)
Окрашенный в вишневый цвет
трифенилметилнатрий обычно получают
восстановлением трифенилхлорметана амальгамой
натрия:
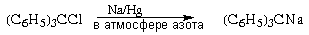
В отличие от обычных СН-связей sp3-гибридного
атома углерода, бензильная С-Н связь три-пара-нитрофенилметана
гетеролитически расщепляется уже спиртовой
щелочью:
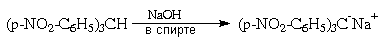
В последнем случае в делокализации
отрицательного заряда в анионе помимо трех
бензольных ядер дополнительно участвуют три
нитро-группы.
Другой вид гетеролитического расщепления
бензильной СН-связи - отрыв гидрид-аниона с
образованием соответствующих карбокатионов
бензильного типа:
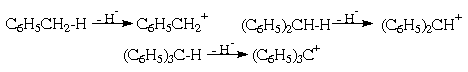
Поскольку бензольные ядра способны
стабилизировать как положительный, так и
отрицательный заряды, фенилированные метаны по
гидридной подвижности водорода в
алифатической части составят тот же ряд, что и по
протонной подвижности, т.е. СН4< С6Н5СН3<
(С6Н5)2СН2< (С6Н5)3СН.
Однако, экспериментально сравнить легкость
отрыва гидрид-аниона, как правило, бывает трудно,
поскольку для осуществления такого отрыва
обычно используют весьма активные кислоты
Льюиса. Сравнительные оценки легко могут быть
сделаны путем сопоставления подвижности
галогена (обычно хлора) в условиях SN1
реакций, поскольку в этом случае, как и при
отщеплении гидрид-аниона, стадией, определяющей
скорость превращения, является образование
соответствующего карбокатиона. Действительно,
оказалось, что в указанных условиях наибольшей
подвижностью хлор обладает в
трифенилхлорметане, а наименьшей - в
бензилхлориде:
Ar-CR2-Cl 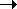 ArCR2+
+ Cl-; R = H или R = Ar ArCR2+
+ Cl-; R = H или R = Ar
скорость реакции: (C6H5)3C-Cl
> (C6H5)2CH-Cl > C6H5CH2-Cl
Реакционная способность хлора в первом из них
напоминает таковую в хлорангидридах карбоновых
кислот, а во втором - в аллилхлориде. Ниже
приведены данные об относительных скоростях
сольволиза хлоридов R-Cl в муравьиной кислоте при
25о С:
R-Cl + HCOOH  R-O-C(O)H +
HCl R-O-C(O)H +
HCl
R |
CH2=CH-CH2 |
C6H5-CH2 |
(CH3)3C |
(C6H5)2CH |
(C6H5)3C |
Относительные скорости |
0.04 |
0.08 |
1 |
300 |
3.106 |
Сравнительная устойчивость
трифенилметильного ( тритильного
) катиона подтверждается также многими другими
экспериментальными данными. Примером может
служить легкость образования его солей с
ненуклеофильными анионами, растворы которых в
полярных апротонных растворителях
электропроводны (а, значит, имеют ионное
строение) и характерно окрашены в желтый цвет:
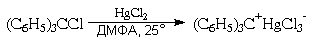
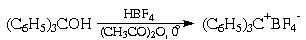
О том же свидетельствует способность
трифенилхлорметана к диссоциации на
трифенилметил-катион и хлорид-анион в растворе
жидкого диоксида серы:
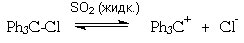
Устойчивость трифенилметильного катиона может
быть еще увеличена введением в бензольные кольца
электронодонорных групп (например, амино-,
алкил- и диалкиламино-, гидроксильной,
алкоксильной). Дальнейшее увеличение
устойчивости карбокатиона приводит к ситуации,
когда он становится устойчивым в водном
растворе, то есть равновесие реакции
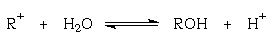
сдвинуто влево. Подобные тритильные катионы не
только устойчивы, но и окрашены. Примером
может служить интенсивно окрашенный в
фиолетовый цвет
три(4-диметиламинофенил)метильный катион. Его
хлорид применяют в качестве красителя под
названием " кристаллический
фиолетовый" . В кристаллическом
фиолетовом положительный заряд рассредоточен
между тремя атомами азота и девятью атомами
углерода бензольных ядер. Участие одного из трех пара-диметиламинофенильных
заместителей в делокализации положительного
заряда может быть отражено с помощью следующих
граничных структур:
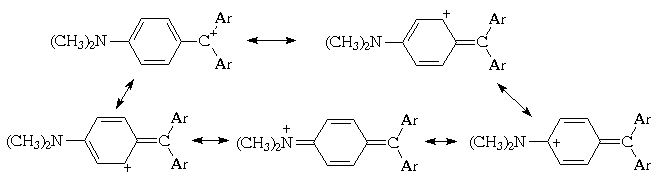
I
Все трифенилметановые красители, содержащие
аминные или замещенные аминные группы в
бензольном кольце(прим.16) ,
приобретают окраску в кислой среде, которая, как
показано выше на примере кристаллического
фиолетового, способствуют возникновению
структуры с протяженной цепью сопряжения
(структура I на схеме) - так называмой хиноидной
структуры . Ниже приведены формулы
наиболее распространенных трифенилметановых
красителей.
| (п-R2N-C6H4)2C+(C6H5)Cl- |
R = CH3 малахитовый зеленый |
| R = C2H5 бриллиантовый зеленый |
| R = H фиолетовый Дебнера |
|
| (п-R2N-C6H4)3C+Cl- |
R = H парафуксин |
| R = CH3 кристаллический фиолетовый |
Аналогичное рассмотренному выше для
трифенилметильных аниона и катиона влияние
должны оказывать бензольные ядра и на
устойчивоть трифенилметильного радикала.
В последнем случае легкость разрыва связи,
образованной центральным атомом углерода с
"не-фенильным" заместителем, обусловлена, в
известной степени, и другими причинами. Дело в
том, что в трифенилметане, трифенилхлорметане,
трифенилкарбиноле и т.п. центральный атом
углерода находится в sp3-гибридном
состоянии и в соответствии с этим имеет
тетраэдрическую конфигурацию. По этой причине
фенильные ядра расположены не в одной плоскости
и не сопряжены. При переходе к
трифенилметил-катиону (гетеролитический разрыв)
или радикалу (гомолитический разрыв) центральный
атом углерода оказывается в sp2-гибридном
состоянии; в результате этого структура
уплощается(прим.17) и взаимодействие
(сопряжение) между тремя фенильными ядрами
усиливается. Это частично компенсирует
энергетические затраты, связанные с
рассматриваемой диссоциацией, и таким образом
облегчает ее.
Трифенилметильный радикал может быть
генерирован из соответствующего хлорида
действием цинка, меди или серебра, которые в этом
случае выступают в качестве доноров электрона:
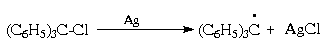
Этот радикал достаточно устойчив и в
разбавленных растворах (в эфире, бензоле)
димеризуется лишь частично. Долгое время этому
димеру приписывали структуру гексафенилэтилена,
однако оказалось, что на самом деле при
димеризации возникает связь между центральным
углеродным атомом одного радикала и пара-положением
одного из фенильных ядер другого радикала :
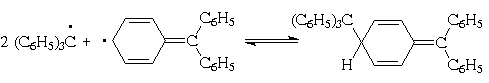
По-видимому, в рассматриваемом случае один
трифенилметильный радикал атакует наименее
пространственно затрудненное место другого,
причем, естественно одно из тех мест, которое
участвует в делокализации неспаренного
электрона.
Степень диссоциации таких димеров сильно
зависит от природы арильных радикалов. Так, в 0.1 М
бензольном растворе при 25о
трифенилметильный радикал димеризован на 97%, а
три-4-нитрофенилметильный не димеризуется
вообще.
|