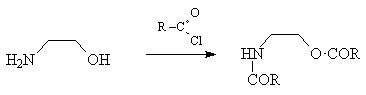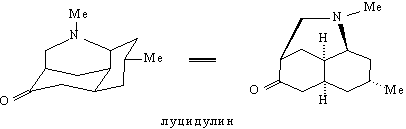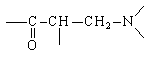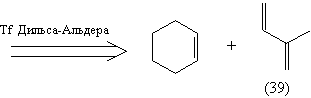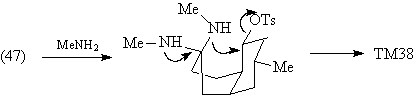|
Планирование многостадийных синтезов./ Органическая химия
Использование защитных групп в
синтезе
В многостадийном синтезе, как правило,
приходится иметь дело с полифункциональными
соединениями. При этом возникают две проблемы.
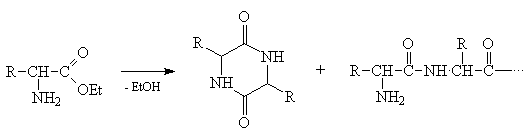
1) Не все функциональные группы совместимы в
одной молекуле. Так, например, эфир  -аминокислоты неустойчив - он легко
образует гетероцикл (дикетопиперазин) наряду с
полимером: -аминокислоты неустойчив - он легко
образует гетероцикл (дикетопиперазин) наряду с
полимером:
Нельзя получить магний- или литийорганическое
соединение, содержащее в молекуле карбонильную
функцию, и т.д.
2) Один и тот же реагент может взаимодействовать
с разными функциональными группами.
В рассмотренных ситуациях используют
избирательную блокаду тех или иных
функциональных групп, создавая так называемые
защитные группы, маскирующие данную функцию. Так,
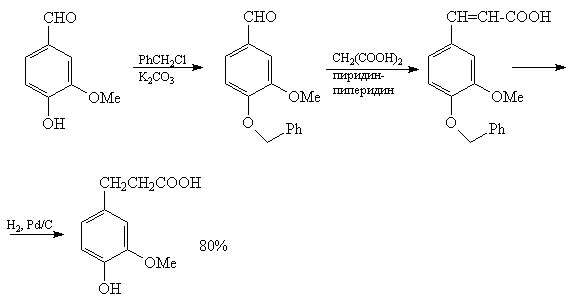
например, реакция Кневенагеля между ванилином и
малоновой кислотой осложняется другими
реакциями, связанными с наличием фенольной
ОН-группы. Поэтому ОН-группу ванилина блокируют,
"защищают" [77].
Таким образом, задача использования защитных
групп включает два момента: создание защитной
группы и удаление, после проведения необходимых
изменений в молекуле.
Одну и ту же функциональную группу можно
защитить различными способами. Вот, например,
некоторые способы создания и удаления защитных
групп для спиртов:
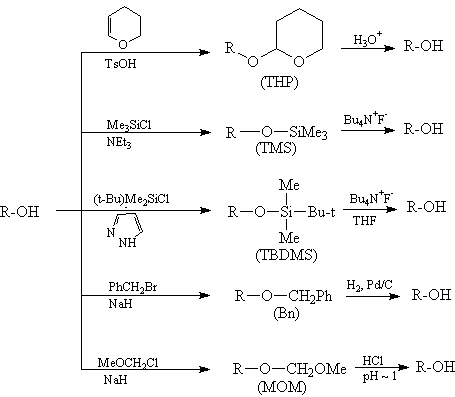
Конкретную защитную группу выбирают с учетом
реагентов и условий реакции так, чтобы в этих
условиях защитная группа не разрушалась.
Например, группа ТНР устойчива в щелочных
условиях (рН 6-12), но неустойчива к водным
растворам кислот и к кислотам Льюиса. ТНР группа
относительно устойчива к действию нуклеофилов и
металлоорганических соединений, к гидридам,
гидрированию и действию окислителей.
Одной из наиболее популярных защитных групп
для спиртов является трет-бутилдиметилсилильная
(TBDMS) группа. Эфиры спиртов с этой группой
устойчивы к действию многих реагентов, причем
защитная группа легко удаляется в условиях, не
затрагивающих другие функциональные группы. TBDMS
защита приблизительно в 104 раз более
устойчива к гидролизу, чем триметилсилильная (TMS)
защита.
Здесь нет нужды подробно останавливаться на
использовании различных защитных групп,
поскольку в настоящее время имеются
исчерпывающие монографии на эту тему [78, 79].
Большое достоинство монографий [79] - наличие в них
корреляционных таблиц, позволяющих предсказать
поведение данной защитной группы в тех или иных
условиях.
Сейчас выработаны определенные стратегии,
позволяющие использовать защиту различных групп
в процессе данного синтеза. Эти подходы изложены
в обзоре [80].
В настоящее время выделяют две основные
стратегические линии при использовании защитных
групп: а) принцип "ортогональной
стабильности" и б) принцип "модулированной
лабильности". Эти принципы относятся к тем
случаям, когда в процессе синтеза одновременно
используются несколько различных защитных
групп.
Принцип ортогональной стабильности
требует, чтобы каждая из используемых защитных
групп удалялась в таких условиях, в которых
остальные защитные группы остаются без
изменений. В качестве примера можно привести
сочетание тетрагидропиранильной, бензоильной и
бензильной групп.
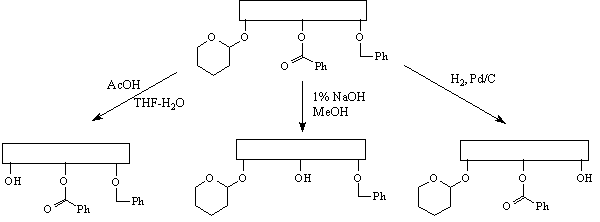
При таком подходе данную защитную группу можно
удалить на любой стадии синтеза.
Принцип модулированной лабильности
подразумевает, что все используемые защитные
группы удаляются в сходных условиях, но с
различной легкостью, например:
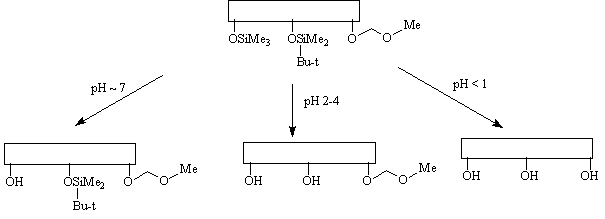
При этом наименее кислотно-чувствительную
метоксиметильную защитную группу нельзя
удалить, не затронув остальные защитные группы.
В настоящее время в арсенале химика-синтетика
имеется большое число различных защитных групп.
Однако, синтез надо стремиться планировать так,
чтобы обойтись либо совсем без защитных групп,
либо свести их применение к минимуму.
Здесьуместнопривестиоченьважнуюфразуизобзора
[80]: "The best protecting group is no protecting group".("Самая
лучшая защитная группа - отсутствие защитной
группы")
Следует помнить, что использование защитных
групп в синтезе требует дополнительных операций.
Это удлиняет и удорожает синтез. Кроме того,
применение защитных групп, как правило,
отрицательно сказывается на выходе целевого
продукта.
Выбор стратегии анализа
Как уже было сказано, в ходе анализа надо
использовать как можно больше стратегических
подходов. Однако, часто одна из стратегических
линий оказывается основной, определяющей в
анализе (и, соответственно, в синтезе). Рассмотрим
в качестве примера анализ молекулы луцидулина -
алкалоида, содержащегося в некоторых видах
плаунов (Lycopodium).
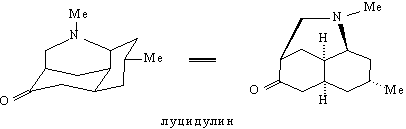
Наличие в молекуле луцидулина группировки
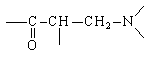
легко создаваемой реакцией Манниха, однозначно
подсказывает первое расчленение, дающее
значительное упрощение структуры:
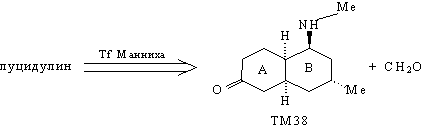
По существу, задача синтеза луцидулина
сводится к задаче синтеза ТМ38. В структуре
молекулы этого соединения видно определенное
расположение карбонильной группы в кольце А по
отношению к кольцу В, которое побуждает
воспользоваться трансформом Робинсона. Тогда
анализ ТМ38 будет выглядеть следующим образом.
Анализ 1
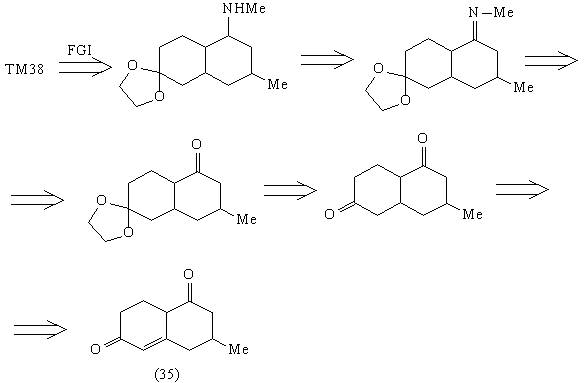
Соединение (35) содержит ретрон аннелирования по
Робинсону, в соответствии с которым и проводим
дальнейшие расчленения:
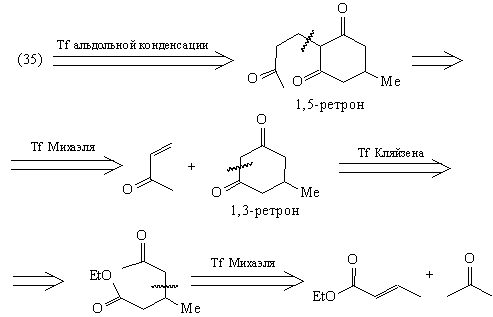
Таким образом, рассмотренный анализ ТМ38 привел
к доступным соединениям: эфиру кротоновой
кислоты, ацетону и метилвинилкетону. Этот анализ
позволяет спланировать построение скелета
молекулы ТМ38, однако не дает возможности создать
нужные стереосоотношения в молекуле. Для решения
этой задачи следует руководствоваться другой
стратегией, а именно базирующейся на
стереохимии.
В основе структуры ТМ38 находится система
цис-декалина, создавать которую можно, базируясь
на таких мощных реакциях (см. табл.1), как реакция
Дильса-Альдера и сигматропные перегруппировки,
которые идут стереоселективно.
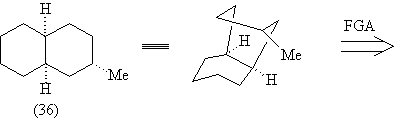
Рассмотрим остов молекулы ТМ(38) (36). Добавление
двух кратных связей в структуру (36) формирует
ретрон перегруппировки Коупа в (37), а
соответствующий трансформ приводит к ретрону
Дильса-Альдера в молекуле (38).
Анализ 2.

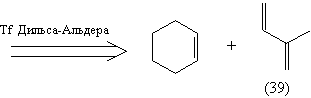
Полученное соединение (39) малопригодно в
качестве диенофила в реакции Дильса-Альдера
(отсутствует электроноакцепторная группа).
Учитывая это, а также то, что остов (36) не содержит
необходимых функциональных групп, модифицируем
молекулу (37), введя в нее группы, легко
превращаемые в карбонильные:
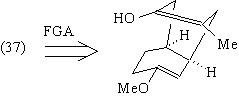
В этом случае остов (36) превращается в
промежуточное (в синтезе ТМ38) соединение (40),
анализ которого теперь очевиден.
Анализ 3
Конечно, в процессе синтеза вместо кетена в
реакции Дильса-Альдера лучше использовать его
синтетический эквивалент - a-хлоракрилонитрил.
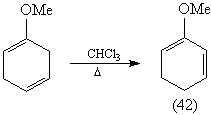
Диен (42) может быть получен [81] изомеризацией
несопряженного диена – продукта восстановления
анизола по Берчу:
На данном этапе синтеза характер задачи
меняется. Теперь надо спланировать синтез ТМ38 из
заданного соединения (40), подход к которому
продиктован предшествующей стереохимической
стратегией. По существу, необходимо видоизменить
и переместить в соседнее положение
функциональную группу в ТМ38. Наиболее
рационально такой подход осуществить на базе
создания кратной связи С=С между соседними
положениями молекулы. Такая практика, кроме того,
позволит контролировать стереохимию реакций за
счет особенностей цис-декалиновой системы.
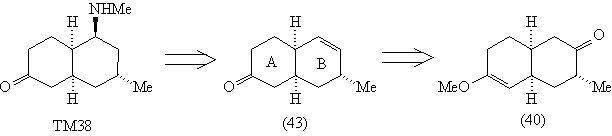
В молекуле (43) поднятое вверх шестичленное кольцо
(А) создает стерические препятствия подходу
реагента к С=С связи сверху (это хорошо видно на
модели).
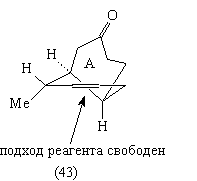
Теперь можно изобразить недостающую часть
анализа ТМ38, базируя стратегию на функциональных
группах и стереохимии.
Анализ 4
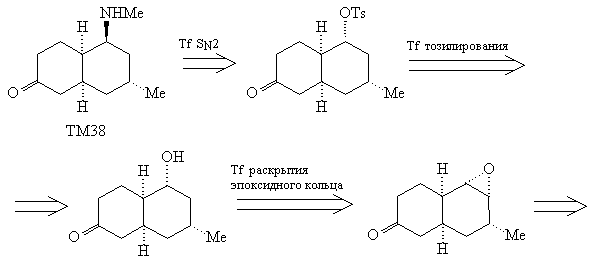
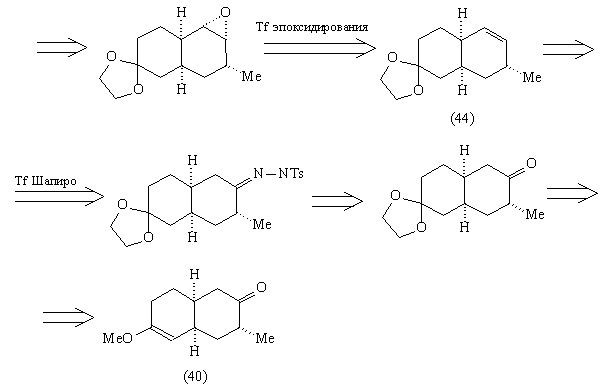
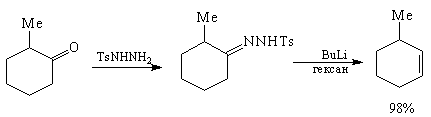
Использованному в анализе 4 трансформу Шапиро
соответствует региоселективный метод создания
наименее замещенной связи С=С реакцией Шапиро [82]
через тозилгидразоны, например:
Эпоксидирование алкена (44) должно проходить с
нужной нам стереоселективностью, благодаря
описанным выше особенностям цис-декалиновой
системы. Для использования трансформа
эпоксидирования в анализе прежде необходимо
защитить карбонильную группу, чтобы исключить
конкурирующую реакцию Байера-Виллигера.
Опубликованный синтез ( ± -луцидулина [83]
соответствует проведенным нами анализам 2-4.
Синтез
Мостиковый кетон (41) был получен из
анизола: 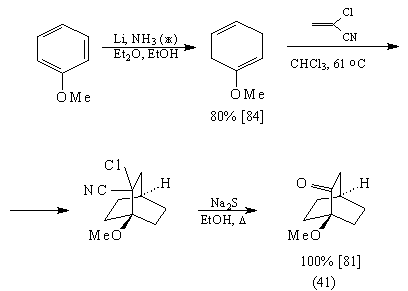
Присоединение изопропенилмагнийбромида к
кетону (41) идет стереоселективно, так что
изопропенильная группа преимущественно
оказывается с менее стерически затрудненной
стороны молекулы [85]: 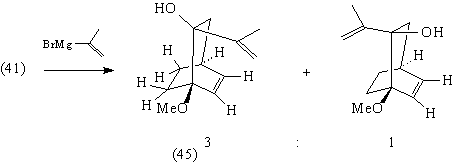
При нагревании изомера (45) происходит
[3,3]-сигматропная окси-перегруппировка Коупа, в
результате которой возникает карбонильная
группа и эфир енола, легко превращаемый в кеталь
(46) [83, 85]:
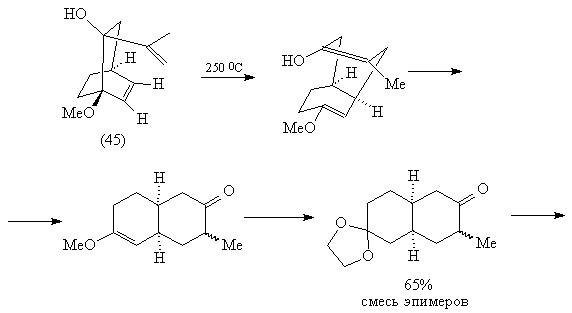
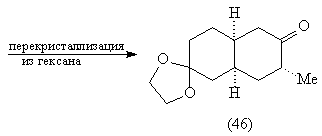
Дальнейшие превращения также соответствуют
проведенному выше анализу. 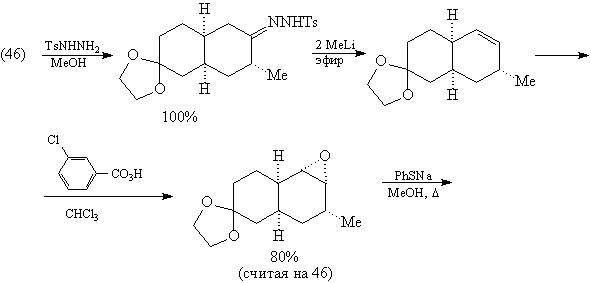
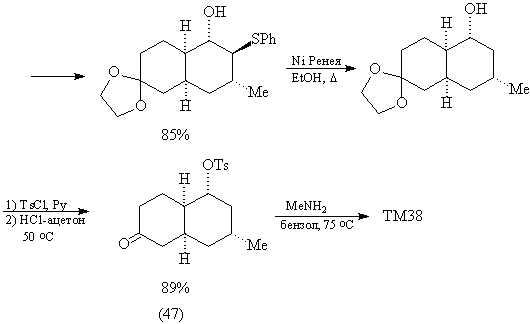
Считают [83], что образование ТМ38 происходит
через промежуточный аминаль:
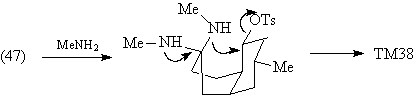
Последняя стадия в синтезе луцидулина - реакция
Манниха кетона ТМ38. 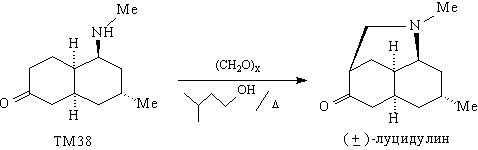
|