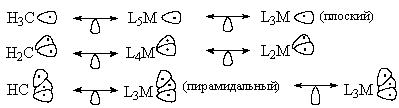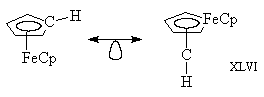|
Бутин К.П. Теоретическая стереохимия/ Органическая химия
8.8. Аналогия изолобальности
Представим, что из октаэдрического (ML6)
или плоского квадратного (ML4) комплекса
лиганды можно удалят не в виде оснований Льюиса с
неподеленной парой (L:), а в виде
катион-радикальных частиц (L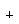 ), т.е. путем гомолитического разрыва связи
M-L. Тогда получим "радикальные" фрагменты MLn: ), т.е. путем гомолитического разрыва связи
M-L. Тогда получим "радикальные" фрагменты MLn:
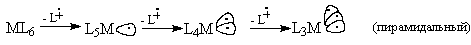
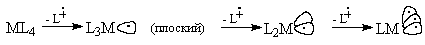
По форме гибридных орбиталей, на которых
находятся один, два или три неспаренных
электрона, фрагмент L5M похож на фрагмент L3M
(плоский), фрагмент L4M - на L2M , а L3M
(пирамидальный) - на LM. Эти пары фрагментов
называют изолобальными (от английского lobe
- доля, лопасть). Более того, фрагменты L5M и L3M
(плоский) изолобальны, например, пирамидальному
метильному радикалу, и изолобальны триплетному
карбену, а (пирамидальный) и LM изолобальны
квадруплетному метну. Аналогия изолобальности
обозначается обоюдоострой стрелкой с петлей
посредине в форме "слезы".
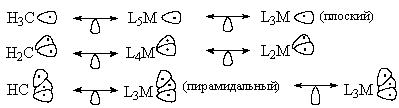
Согласно определению, фрагменты LnM
или устойчивые молекулы LnM называются
изолобальными, если они имеют одинаковые число,
симметрию и заселенность граничных орбиталей.
На приведенной ниже схеме представлены
некоторые конкретные случаи изолобальности.
Схема 28.1.
8 электронов 18 электронов 16 электронов
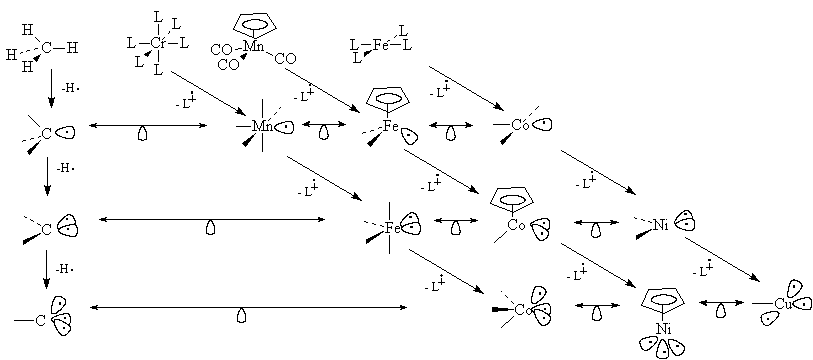
При удалении L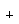 из
18-электронной молекулы CrL6 образовался бы
17-электронный анион-радикал CrL5 из
18-электронной молекулы CrL6 образовался бы
17-электронный анион-радикал CrL5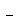 . Чтобы не возникало неудобств,
связанных с различием зарядов при переходе от CrL6
к CrL5 . Чтобы не возникало неудобств,
связанных с различием зарядов при переходе от CrL6
к CrL5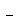 ,
последний заменим на изоэлектронный фрагмент MnL5,
который электрически нейтрален, имеет одну
гибридную орбиталь, направленную в сторону от
лигандов (табл. 28.2), и на этой орбитали находится
один электрон. Граничная орбиталь
пирамидального метильного радикала тоже
гибридизована в сторону от "лигандов"
(атомов Н). Это означает, что MnL5 и СН3
изолобальны. То же относится и к неорганическому
комплексу Co(CN)53-, и вообще, ко всем
другим фрагментам d7-ML5. Отметим, что
как для СН3, так и для некоторых фрагментов d7-ML5
с помощью низкотемпературной матричной
изоляции можно зарегистрировать спектры ЭПР. Эти
частицы и химически подобны, а именно, они
вступают в реакции отрыва радикалов от других
молекулы и в реакции димеризации (2СН3.
а С2H6; 2L5M а M2L10). ,
последний заменим на изоэлектронный фрагмент MnL5,
который электрически нейтрален, имеет одну
гибридную орбиталь, направленную в сторону от
лигандов (табл. 28.2), и на этой орбитали находится
один электрон. Граничная орбиталь
пирамидального метильного радикала тоже
гибридизована в сторону от "лигандов"
(атомов Н). Это означает, что MnL5 и СН3
изолобальны. То же относится и к неорганическому
комплексу Co(CN)53-, и вообще, ко всем
другим фрагментам d7-ML5. Отметим, что
как для СН3, так и для некоторых фрагментов d7-ML5
с помощью низкотемпературной матричной
изоляции можно зарегистрировать спектры ЭПР. Эти
частицы и химически подобны, а именно, они
вступают в реакции отрыва радикалов от других
молекулы и в реакции димеризации (2СН3.
а С2H6; 2L5M а M2L10).
Удаляя второй лиганд (L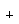 ) от MnL5 и сдвигаясь на одну клетку
Периодической таблицы правее, получаем фрагмент
FeL4. Он изолобален метилену СН2. Удаляя
третий лиганд, получаем пирамидальный фрагмент
CoL3, изолобальный СН. ) от MnL5 и сдвигаясь на одну клетку
Периодической таблицы правее, получаем фрагмент
FeL4. Он изолобален метилену СН2. Удаляя
третий лиганд, получаем пирамидальный фрагмент
CoL3, изолобальный СН.
Если начинать с 16-электронного плоского
квадратного комплекса FeL4, то
последовательно удаляя один, два и три и
сдвигаясь по периоду вправо, получим СоL3, NiL2
и CuL, изолобальные, соответственно, СН3, СН2
и СН. В принципе, для построения изолобальных
серий можно исходить из многих соединений,
например, из CpMn(CO)3, как показано на схеме 28.1.
Пользуясь аналогией изолобальности, можно
легко и быстро строить молекулы сложных
металлоорганических соединений из фрагментов MLn
Рассмотрим несколько примеров.
1. Циклопропан "состоит" их трех фрагментов
СН2. Заменяя СН2 в циклопропане на
изолобальные фрагменты Fe(CO)4, Ni(PPh3)2или
CpCo(CO), получаем маталл-олефиновые комплексы
(напомним, что металлациклопропаны не отличимы
от p-комплексов металл-олефин; см. раздел 28.6.4).
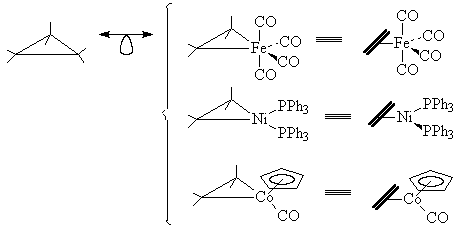
Заменяя две или три группы СН2 на
изолобальные фрагменты Fe(CO)4 или CpRhCO,
получим следующие соединения:
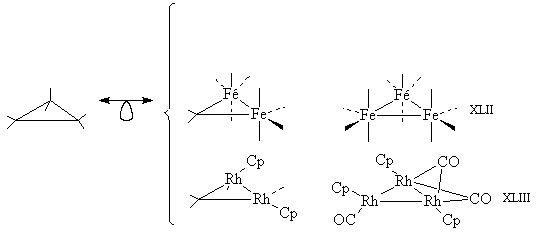
Все эти соединения известны. В трехядерных кластерах
(от английского cluster – гроздь) XLII и XLIII два
СО-лиганда образуют мостики между атомами
металла. В циклопропане таких мостиков (с атомами
водорода), естественно, нет; они существуют в
карбокатионах и диборанах, т.е. в
электронодефицитных молекулах. Однако в очень
качественном смысле орбитали мостиковых
соединений похожи на орбитали с концевыми
группами СО. Из аналогии изолобальности нельзя
предсказатель существование мостиковых
структур, и мы их указали в формулах XLII и XLIII лишь
потому, что точно известно, что карбонильный
мостик в этих молекулах есть. Заметим, что в
кластере Fe3(CO)12 два карбонила
образуют мостики, но в изоэлектронных Ru3(CO)12
и Os3(CO)12 все СО-группы концевые. Это
просто означает, что энергетическое различие
между мостиковыми и немостиковыми структурами
очень мало.
2. Наиболее стабильным органическим
соединением, содержащим группу СН2,
является этилен. Очевидно, что могут
существовать комплексы типа XLIV и XLV.
Действительно, соединение XLIV можно
синтезировать, но комплекс XLV был получен лишь в
матрице при низких температурах. Причина
кинетической нестабильности XLV состоит в том, что
p-орбиталь Fe=Fe расположена очень высоко, а
p*-орбиталь очень низко, и поэтому молекула
чрезвычайно реакционноспособна.
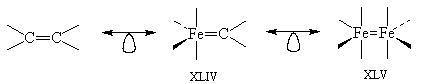
3. Из аналогии изолобальности можно вывести
изомер ферроцена необычной структуры. Поскольку
CpFe изолобален СН, получаем:
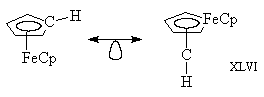
Расчеты показывают, что изомер XLVI значительно
менее стабилен, чем классический ферроцен. Это
обусловлено тем, что железо гораздо менее
электроотрицательно, чем углерод, и поэтому в
неклассическом изомере энергия s-связей C-Fe в
металлацикле (который по аналогии с пирролом
можно назвать ферролом) очень велика. Аналогия
изолобальности позволяет по известным
брутто-формулам вывести (или предположить)
структурную формулу металлоорганического
комплекса. Например, какова структура комплекса
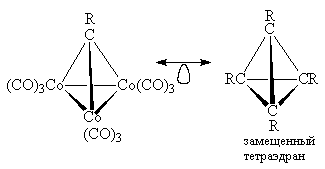
(CO)9Co3(CR)? Решая этот вопрос, рассуждаем
следующим образом. Очевидно, что структурными
фрагментами этого соединения являются три
фрагмента Со(СО)3 и изолобальный им
фрагмент CR. Каждый атом Со в Со(СО)3 и атом С
в CR имеют по три граничные орбитали, и поэтому
каждый фрагмент должен быть связан с тремя
другими фрагментами. Следовательно, комплекс
должен иметь строение тригональной пирамиды, в
четырех вершинах которой расположены три атома
кобальта и атом углерода. Этот комплекс
изолобален тетраэдрану:
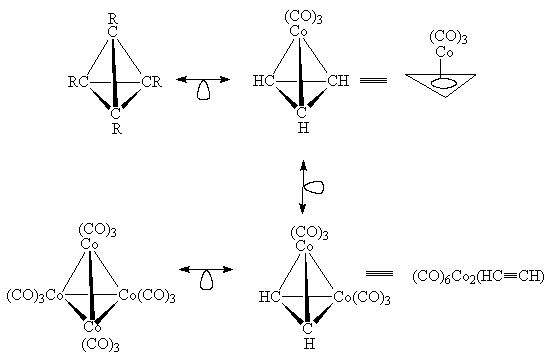
Последовательным замещением групп CR в
тетраэдране на изолобальные группы Со(СО)3
можно получить другие аналогичные 18-электронные
комплексы кобальта:
|