Реакции окисления.
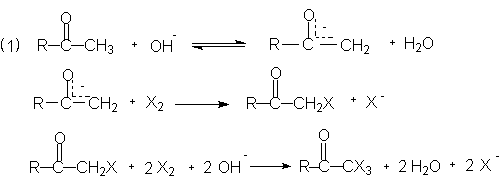
Действие галогенов (Cl2, Br2, J2) в водно-щелочной среде на метилкетоны (RCOCH3) приводит к окислительному расщеплению –C(O)-CH3 группы и образованию карбоновых кислот (точнее карбоксилатов) и тригалогенметанов (галоформов).
![]()
Реакция галоформного расщепления протекает в две стадии : вначале происходит галогенирование образующегося в щелочной среде енолят-иона алкил(арил)метилкетона ( в щелочной среде метилкетоны образуют енолят-анионы по метильной группе благодаря большей С-Н кислотности последней).
a-Галогензамещенный кетон, обладая повышенной активностью депротонируется с более высокой скоростью по сравнению с енолизацией исходного карбонильного соединения, в результате этого при галогенировании всегда образуются 1,1,1-тригалогенметилкетоны.
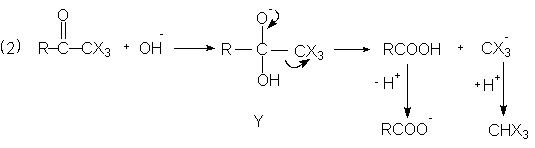
Введение трех атомов галогена в метилкетоны повышает карбонильную активность полученного кетона (благодаря –J эффекту CHal3-группы) и облегчает атаку гидроксид-иона на карбонильный атом углерода. Образовавшийся аддукт Y стабилизируется в результате распада до карбоновой кислоты и тригалогенметил-аниона с последующей миграцией протона от кислоты и образованием карбоксилата и галоформа.
Галоформная реакция широко используется в препаративной органической химии для получения различных аренкарбоновых кислот из арилметилкетонов. Данная реакция также служит для идентификации метилкетонов (и окисляемых спиртов R-CHOH-CH3) –образование нерастворимого желтого осадка иодоформа (CHJ3).
6.1. Анисовая кислота.
Методика.
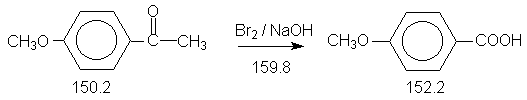
Константы исходных и синтезированного соединений. Приведены формула, т.пл.оС, т.кип.оС.
4-CH3CO-C6H4-OCH3, 39.0,
265.0 ;
Br2,-7.2, 58.7, d420 3.1;
CHBr3, 9.2, 149.0,d420 2.89 ;
NaOH, 319.0, 1390.0 ;
HCl (25 %) -, 110 ;
SO2, -76.0, -10.0 ;
диоксан, 11.3, 101.4, d420 1.03;
C2H5OH, -117.0, 78.4, d420
0.79;
4-CH3O-C6H4-COOH (анисовая
кислота), 184.0.
Проведение синтеза.
В трехгорлой колбе (500 мл), снабженной магнитной мешалкой, термометром, капельной воронкой и обратным холодильником (прибор 4) растворяют 40.0 г(1 моль) гидрокcида натрия в 200 мл воды и при интенсивном перемешивании и охлаждении по каплям добавляют 48.0 г (0.3 моля) брома с такой скоростью, чтобы температура не поднималась выше 10оС (тяга!). Охлаждают колбу до ОоС и затем по каплям прибавляют раствор 15.0 г(0.1 моля) п-метоксиацетофенона в 100 мл диоксана, не допуская повышения температуры выше 10оС.
Обработка реакционной смеси.
Образующийся в реакции бромоформ отделяют в делительной воронке, щелочной растворо встряхивают с раствором 10 г бисульфита натрия (Na2S2O5) в 150 мл воды (для разложения избытка брома) и затем подкисляют конц. соляной кислотой (тяга , выделение SO2). Выпавшую анисовую кислоту отфильтровывают на стеклянном фильтре.
Очистка.
Продукт перекристаллизовывают из смеси этанол/вода (1:1) и получают бесцветные кристаллы, т.пл. 184оС, выход 12.2 г(80 %)/
Примечание:~ 100 мл раствора этанол-вода могут быть собраны и очищены перегонкой.
Отходы, подлежащие утилизации:~20 мл бромоформа, 450 мл маточного раствора (вода-диоксан).
Методы обработка реакционной смеси: 2.1, 3.2.
Методы выделения полученного соединения: 3.1,
6.2. Дибензилсульфон.
Окисление органических сульфидов (тиоэфиров) до сульфонов идет через промежуточно образующиеся сульфоксиды.
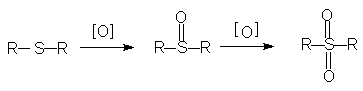
В качестве окислителя используют перекись водорода в уксусной кислоте или азотную кислоту. Сульфоны обладают повышенной a-C-H кислотностью (из-за сильного –J эффекта SO2-группы). Кроме того, RSO2 -группа является хорошо уходящей группой (в виде сульфинат-аниона в реакции нуклеофильного замещения у насыщенного sp3 атома углерода). Благодаря наличию в сульфонах этих двух реакционных центров возможно использование сульфонов в органическом синтезе.
Методика.
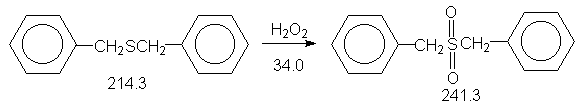
Константы исходных и синтезированого соединений. Приведены формула, т.пл.оС,т.кип.оС.
CH3COOH,16.6, 118.0, d420 1.0 ;
(PhCH2)2S,47 ;
(PhCH2)2SO2,151.
Проведение синтеза.
В трехгорлой колбе (100 мл), снабженной обратным холодильником, капельной воронкой, термометром и магнитной мешалкой (прибор 4) растворяют при нагревании 5.0 г(0.023 моля) дибензилсульфида в 20 мл ледяной уксусной кислоты. Охлаждают реакционную смесь до 25-30оС и при перемешивании прибавляют 7 мл (0.062 моля) 30 % -ного раствора перекиси водорода с такой скоростью, чтобы температура реакционной смеси не поднималась выше 75оС. Нагревают реакционную смесь при 85оС при перемешивании еще 3 часа.
Обработка реакционной смеси и очистка полученного продукта.
Реакционную смесь охлаждают до 0оС (ледяная баня). Выпавшие кристаллы отфильтровывают на воронке со стеклянным фильтром, промывают водой и сушат в эксикаторе над P2O5. Получают 5.2 г (92 %) сульфона в виде бесцветных листочков с т.пл. 151оС.
Отходы, подлежащие обезвреживанию :~40 мл маточного раствора сульфона.
Восстановление карбонильной группы.
6.3. 4-(п-Толил)-4-гидроксимасляная кислота.
Исходная b-(4-метилбензоил)пропионовая кислота содержит две функциональные группы –карбонильную и карбоксильную,обладающие разной карбонильной активностью. Такой активный реагент как алюмогидрид лития восстанавливает обе группы: кетогруппу до вторичной, а карбоксильную группу до первичной спиртовой группы. Борогидрид натрия восстанавливает кетокарбоновую кислоту селективно до оксикарбоновой кислоты, которая в ходе реакции циклизуется в соответствующий g-лактон. Последний выделяют и затем гидролизуют водной щелочью (лактонное расщепление в щелочной среде). После подкисления соляной кислотой при 0оС выделяют оксикислоту.
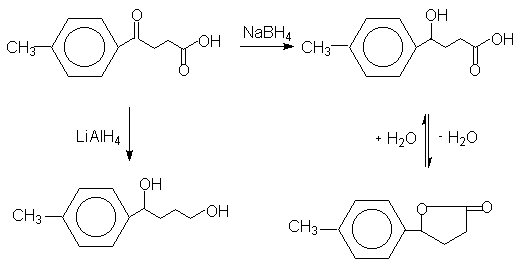
Методика.
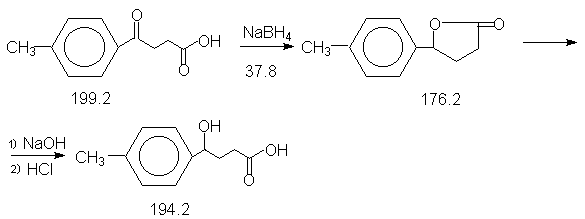
Константы исходных и синтезированных соединений. Приведены формула, т.пл.оС, т.кип.оС.
CH3OH,-94.0, 64.6, d420 0.79 ;
(C2H5)O, -116.0, 34.5, d420
0.71;
C2H5OH, -117.0, 78.4, d420
0.79 ;
NaOH, 319.0, 1390 ;
HCl (25%),-,110.0 ;
NaBH4, 36.0, 500 ;
4-CH3-C6H4-CO(CH2)2COOH,
126-127 ;
g-лактон, 73-74 ;
4-CH3-C6H4-CH(OH)(CH2)2COOH,
91-92.
Проведение синтеза.
а) получение ![]() -лактона.
-лактона.
В трехгорлую колбу (500 мл), снабженную
механической мешалкой и обратным холодильником
помещают 95 мл метанола, 5 мл воды и 3 г(0.075 моля)
гидроксида натрия. В спиртовом растворе щелочи
растворяют 9.61 г (0.05 моля)
![]() -(4-метилбензоил)пропионовой
кислоты . Затем при перемешивании и охлаждении
ледяной водой прибавляют порциями 9.45 г (0.25 моля)
боргидрида натрия. Реакционную смесь
перемешивают при комнатной температуре в
течение двух часов.
-(4-метилбензоил)пропионовой
кислоты . Затем при перемешивании и охлаждении
ледяной водой прибавляют порциями 9.45 г (0.25 моля)
боргидрида натрия. Реакционную смесь
перемешивают при комнатной температуре в
течение двух часов.
Обработка реакционной смеси.
При охлаждении ледяной водой из капельной воронки добавляют 200 мл воды и 100 мл 6N HCl (Осторожно ! Сильное вспенивание!), рН смеси должно быть1-2 (по универсальному индикатору). Реакционную смесь экстрагируют эфиром (3 х 70 мл) и обьединенные эфирные вытяжки сушат прокаленным сульфатом натрия. Эфир отгоняют с помощью роторного испарителя и остаток полностью закристаллизовывается (этому способствует растирание стеклянной палочкой). Неочищенный продукт перекристаллизовывают из 40 мл смеси этанол-вода (1:1). Сначала продукт растворяют в горячем этаноле, затем добавляют воду до начала помутнения и охлаждают. Получают лактон в виде бесцветных кристаллов,6.2 г (70 %), т.пл. 73-74оС.
б) 4-(п-толил)-4-гидроксимасляная кислота.
Проведение синтеза и обработка реакционной смеси.
При нагревании растворяют 5.29 г (0.03 моля) лактона в разбавленном растворе гидроксида натрия (4.2 г,0.05 моля NaOH в 30 мл H2O) в течение 10 минут. При охлаждении ледяной водой осторожно добавляют по каплям 22 мл 6N HCl до рН 1-2. Сначала образующаяся кислота выделяется в виде масла, которое при стоянии закристаллизовывается. Осадок отфильтровывают и перекристаллизовывают из 70 мл смеси этанол-вода (1:3). Перекристаллизацию проводят следующим образом: вещество растворяют в горячем этаноле, затем добавляют воду до начала помутнения и охлаждают. После фильтрования и высушивания получают 4.3 г (74 %) оксикислоты в виде бесцветных кристаллов, т.пл. 91-92оС.
Примечание: Приблизительно 210 мл эфира собирают и очищают перегонкой (для вторичного использования в синтезе).
Отходы безвредные : ~ 50 мл водной фазы.
Отходы, требующие утилизации:~ 300 мл водной фазы, осушитель,~ 110 мл маточного раствора (этанол-вода).
6.4. 1-(п-толил)бутан-1,4-диол.
Методика.
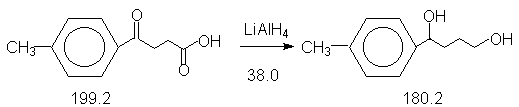
Константы исходных и синтезированного соединения. Приведены формула, т.пл.оС, т.кип.оС.
LiAlH4,125.0, 150.0 ;
тетрагидрофуран,-108.5, 67.0, d420
0.89 ;
NaOH, 319, 1390 ;
(C2H5)2O, -116.0, 34.5, d420
0.71 ;
4-CH3-C6H4-CO(CH2)2COOH,
91-92 ;
4-CH3-C6H4-CH(OH)(CH2)2CH2OH,
53-56.
Проведение синтеза.
В трехгорлую колбу (100 мл), снабженную обратным холодильником, мешалкой и капельной воронкой (прибор 3) помещают суспензию 1.14 г (0.03 моля) алюмогидрида лития (осторожно !) в 20 мл сухого тетрагидрофурана (ТГФ). При перемешивании из капельной воронки по каплям добавляют раствор 4.81 г (0.025 моля) b-(4-метилбензоил)пропионовой кислоты в 20 мл сухого ТГФ. Реакционную смесь осторожно нагревают при умеренном кипении в течение 30 минут.
Обработка реакционной смеси и очистка продукта.
Колбу охлаждают ледяной водой и осторожно последовательно добавляют 5 мл 10 %-ного раствора гидрокарбоната натрия, затем 10 мл 20%-ного раствора гидрокида натрия. Органическую фазу отделяют, водную экстрагируют эфиром (3х25 мл).
При плохом разделении фаз (ТГФ смешивается с водой !) добавляют воду и водную фазу снова экстрагируют эфиром. Обьединенные эфирные вытяжки высушивают сульфатом натрия. Эфир сначала отгоняют при атмосферном давлении, а затем на роторном испарителе. Для кристаллизации в неочищенный продукт добавляют затравку и оставляют на сутки в холодильнике. На следующий день масло полностью закристаллизовывается. Полученный продукт может быть использован далее без предварительной очистки, т.пл. 53-56оС, выход 3.6 г (80 %).
Примечание :~50 мл эфира может быть собрано и очищено перегонкой для использования в синтезе.
Отходы требующие обезвреживания :~ 20 мл водной фазы, осушитель, ~40 мл смеси эфир-ТГФ.