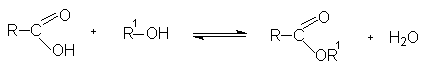
7.1. Этиловый эфир хлоруксусной кислоты.
Эфиры карбоновых кислот получают по реакции этерификации взаимодействием карбоновых кислот со спиртами с отщеплением воды (реакция обратимая).
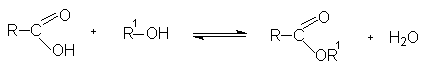
Установление равновесия в реакции ускоряется при добавлении сильных кислот [H2SO4, HCl, п-толуолсульфокислоты (п -TsOH)]. При молярном соотношении реагентов 1:1(спирта и кислоты) в равновесной смеси содержится около 66 % эфира и воды. Для смещения равновесия в сторону образования эфира добавляют либо избыток одного из реагентов (обычно спирта), либо удаляют один из образующихся продуктов (чаще всего воду).
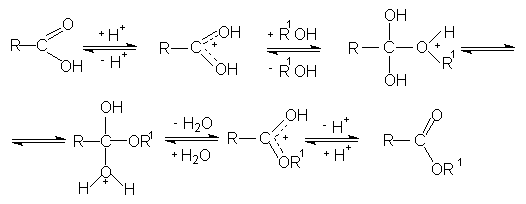
Реакция этерификации лучше всего протекает с первичными спиртами в условиях кислого катализа (активирование карбонильной группы в органических кислотах).
Гидролиз сложных эфиров представляет собой обратную реакцию их образования (этерификацию). Гидролиз может быть осуществлен как в кислой, таки в щелочной среде. Щелочной гидролиз сложных эфиров протекает необратимо, поскольку стабилизированный мезомерией карбоксилат-анион не способен взаимодействовать с нуклеофильной молекулой спирта.
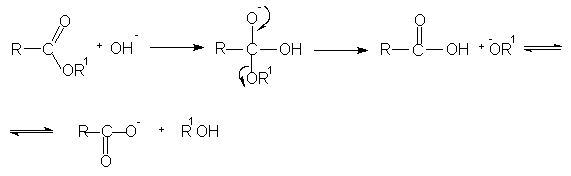
Выделение органических кислот из их солей осуществляют с помощью сильных минеральных кислот.
Методика.
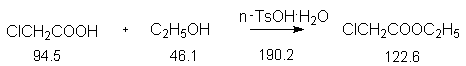
Константы исходных и синтезированного соединений. Приведены формула, т.пл.оС, т.кип.оС.
ClCH2COOH, 62-64, 189 ;
C2H5OH, -117.0, 78.4, d420
0.79 ;
CH3C6H5, -95.0, 110.8, d420
0.87 ;
4-CH3-C6H4-SO3H, 38, 187 ;
ClCH2COOC2H5, -26, 145.0.
Проведение синтеза.
Раствор 23.6 г (0.25 моля) хлоруксусной кислоты, 20 г(0.45 моля, 25 мл) этилового спирта и 1 г моногидрата п-толуолсульфокислоты в 50 мл толуола нагревают в приборе с водоотделителем (насадка Дина-Старка, прибор 8) в течение 90 минут до прекращения выделения воды (отделяется примерно 5 мл воды).
Обработка реакционной смеси.
Реакционную смесь охлаждают, промывают последовательно водой, насыщенными растворами гидрокарбоната натрия и хлорида натрия и сушат сульфатом натрия.
Очистка.
Растворитель отгоняют при атмосферном давлении,а остаток перегоняют в вакууме. Получают 21.8 г (72 %) этилового эфира хлоруксусной кислоты (осторожно, лакриматор !), т.кип. 37-39оС/16 мм Hg, nD20 1.4215. При перегонке приемник охлаждают ледяной водой.
Примечание: Посуду после проведения синтеза промывают под тягой 20 % раствором щелочи. Около 50 мл толуола могут быть собраны и очищены перегонкой для повторного использования.
Отходы безвредные:~ 15 мл смеси вода-этанол и ~15 мл промывных вод.
Отходы, подлежащие обезвреживанию: использованный осушитель, предгон.
Методы обработки реакционной смеси: 2.1, 2.2.
Выделение продукта :3.4.
7.2. Ацетилсалициловая кислота (аспирин).
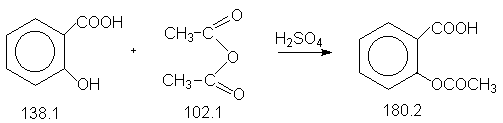
Константы исходных и синтезируемого соединений. Приведены формула,т.пл.оС, т.кип.оС.
2-HO-C6H4COOH, 156.0,211.0 ;
(CH3CO)2O, -73.0, 140.0,d420 1.08
;
H2SO4, 10.3, 338.0 ;
2-HOOC-C6H4OCOCH3, 136.
Проведение синтеза.
В одногорлой колбе (50 мл) с обратным холодильником с хлоркальциевой трубкой (прибор 1) смешивают 6.13 г(0.06 моля) уксусного ангидрида, 6.9 г(0.05 моля) салициловой кислоты и 1-2 капли конц серной кислоты. После завершения экзотермической реакции нагревают реакционную смесь в течение 1 часа на кипящей водяной бане.
Обработка реакционной смеси.
Реакционную смесь охлаждают до комнатной температуры, выливают в 40 мл ледяной воды и отфильтровывают выпавшие кристаллы.
Очистка.
Перекристаллизовывают из воды и сушат в вакуум-эксикаторе над P2O5. Получают 7.65 г (85 %) продукта в виде бесцветных кристаллов, т.пл. 136оС.
Методы обработки реакционной смеси и очистка полученного продукта : 3.2, 3.1, 2.2.
Отходы безвредные :~ 100 мл маточного раствора (из реакции и перекристаллизации).