2.3. Общее выражение для скорости производства энтропии
Наиболее отчетливо структура функции производства энтропии для каждого типа
неравновесных процессов проявляется в дифференциальных уравнениях (2.7), (2.13)
и (2.24). Приращение энтропии задается произведениями двух величин: 1)
количества субстанции, переносимой или превращаемой внутри системы, 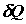 или или 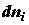 , и 2)
разности значений некоторого интенсивного параметра, характеризующего частичное
отклонение системы от равновесия – теплового, концентрационного или
химического. Отклонение от теплового равновесия выражается через разность
обратных температур взаимодействующих частей системы; отклонение от
концентрационного равновесия – через разности химических потенциалов
компонентов в разных частях системы; отклонение от химического равновесия –
разностью сумм химических потенциалов исходных реагентов и продуктов реакции.
Указанные разности являются "движущими силами" соответствующих
самопроизвольных процессов. Производство энтропии, рассчитанное на единичное
количество перенесенной или превращенной субстанции, зависит исключительно от
величины "движущей силы". , и 2)
разности значений некоторого интенсивного параметра, характеризующего частичное
отклонение системы от равновесия – теплового, концентрационного или
химического. Отклонение от теплового равновесия выражается через разность
обратных температур взаимодействующих частей системы; отклонение от
концентрационного равновесия – через разности химических потенциалов
компонентов в разных частях системы; отклонение от химического равновесия –
разностью сумм химических потенциалов исходных реагентов и продуктов реакции.
Указанные разности являются "движущими силами" соответствующих
самопроизвольных процессов. Производство энтропии, рассчитанное на единичное
количество перенесенной или превращенной субстанции, зависит исключительно от
величины "движущей силы".
Термодинамика неравновесных процессов дает общее выражение для локальной
скорости производства энтропии в каждом элементарном единичном объеме
неравновесной системы
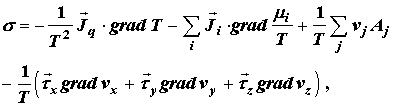 (2.25) (2.25)
где 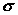 –
скорость производства (функция источника) энтропии, Дж К-1сек-1м-3; –
скорость производства (функция источника) энтропии, Дж К-1сек-1м-3;
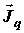 – поток
теплоты; – поток
теплоты; 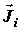 –
диффузионный поток i-го химического компонента; –
диффузионный поток i-го химического компонента; 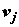 – скорость j-й
химической реакции; Aj – химическое сродство
(притяжение) системы по отношению к j-й реакции; – скорость j-й
химической реакции; Aj – химическое сродство
(притяжение) системы по отношению к j-й реакции; 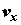 , , 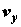 и и 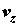 – компоненты вектора скорости
среды; – компоненты вектора скорости
среды; 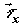 , , 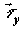 , и , и 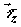 – диффузионные
потоки соответственно x-, y- и z – компонент вектора
импульса. Как легко видеть, первые три слагаемых правой части (2.25)
соответствуют по своей структуре полученным выше выражениям (2.7), (2.13) и
(2.24). Последнее слагаемое (2.25), характеризующее производство энтропии за
счет самопроизвольного переноса импульса, ради упрощения записано здесь
применительно к течению несжимаемой среды. Таким образом, производство энтропии
является универсальным показателем, суммарным образом характеризующим степень
удаленности различных процессов, происходящих в системе, от равновесных
условий. – диффузионные
потоки соответственно x-, y- и z – компонент вектора
импульса. Как легко видеть, первые три слагаемых правой части (2.25)
соответствуют по своей структуре полученным выше выражениям (2.7), (2.13) и
(2.24). Последнее слагаемое (2.25), характеризующее производство энтропии за
счет самопроизвольного переноса импульса, ради упрощения записано здесь
применительно к течению несжимаемой среды. Таким образом, производство энтропии
является универсальным показателем, суммарным образом характеризующим степень
удаленности различных процессов, происходящих в системе, от равновесных
условий.
С позиций конструктивной теории технологических процессов нет необходимости
подходить к равновесным траекториям процессов как к абсолютной абстракции.
Основное значение имеет относительная величина производства энтропии по
сравнению с общим масштабом изменения энтропии рабочего вещества. Поэтому практически
равновесным (квазиравновесным) процессом может считаться такой, который
осуществляется при достаточно малых, но конечных движущих силах, обеспечивающих
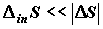 . Широко
распространена точка зрения на равновесные процессы как бесконечно медленные.
Однако это слишком упрощающий и не конструктивный взгляд на проблему. Как видно
из уравнений производства энтропии, последние никак не учитывают конкретные
механизмы процессов, и в них вообще не фигурируют кинетические характеристики.
Поэтому требование очень медленного осуществления процесса как необходимое
условие его квазиравновесности ниоткуда не вытекает. В принципе и при очень
малых движущих силах – за счет рациональной постадийной организации реального
процесса и повышения абсолютных кинетических характеристик его стадий
(коэффициентов тепло- и массопереноса, констант скоростей реакций) могут быть
обеспечены достаточно высокие скорости процесса в целом. При этом оказывается
возможным обойтись без гипотетических цилиндров с поршнями, термостатов и
хемостатов. . Широко
распространена точка зрения на равновесные процессы как бесконечно медленные.
Однако это слишком упрощающий и не конструктивный взгляд на проблему. Как видно
из уравнений производства энтропии, последние никак не учитывают конкретные
механизмы процессов, и в них вообще не фигурируют кинетические характеристики.
Поэтому требование очень медленного осуществления процесса как необходимое
условие его квазиравновесности ниоткуда не вытекает. В принципе и при очень
малых движущих силах – за счет рациональной постадийной организации реального
процесса и повышения абсолютных кинетических характеристик его стадий
(коэффициентов тепло- и массопереноса, констант скоростей реакций) могут быть
обеспечены достаточно высокие скорости процесса в целом. При этом оказывается
возможным обойтись без гипотетических цилиндров с поршнями, термостатов и
хемостатов.
|

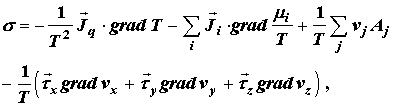 (2.25)
(2.25)