Константа
Константа скорости химической реакции k [[концентрация]1-n. [время]-1] – коэффициент пропорциональности в кинетическом уравнении реакции; численно равна скорости при единичных постоянных концентрациях реагирующих веществ. Размерность определяется общим порядком реакции n.
Зависимость константы скорости от температуры передает уравнение Аррениуса:
![]() ,
,
ko - предэкспоненциальный множитель,
определяется типом реакции, EA - энергия
активации.
Константа химического равновесия –
безразмерная величина Ka (или Kx,),
выражающая для данной химической реакции ![]() соотношение между
равновесными значениями активностей ai (или
xi,) реагирующих веществ Bi в форме:
соотношение между
равновесными значениями активностей ai (или
xi,) реагирующих веществ Bi в форме:
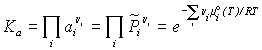
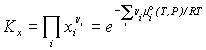 ,
,
где n i - стехиометрические коэффициенты
(положительные для продуктов реакции и
отрицательные для исходных веществ), ![]() - относительное
парциальное давление i-го в-ва в момент
установления равновесия,
- относительное
парциальное давление i-го в-ва в момент
установления равновесия, ![]() - стандартный химический потенциал,
зависящий от природы реагента и температуры (Ka)
или температуры и давления (Kx). Помимо Ka
и Kx используют также константы KP и Kc,
которые можно выразить через непосредственно
определяемые в опыте значения парциальных
давлений Pi и концентраций сi
- стандартный химический потенциал,
зависящий от природы реагента и температуры (Ka)
или температуры и давления (Kx). Помимо Ka
и Kx используют также константы KP и Kc,
которые можно выразить через непосредственно
определяемые в опыте значения парциальных
давлений Pi и концентраций сi
![]() ,
, ![]() ( закон действующих масс).
( закон действующих масс).
Эти константы имеют размерность [KP] = [давление]![]()
![]() , [Kc] = [молярность]
, [Kc] = [молярность]![]()
![]() . Константы Ka, Kx, KP
и Kc связаны между собой соотношениями:
. Константы Ka, Kx, KP
и Kc связаны между собой соотношениями:
Kx = Ka (P/Po )-![]() n KP = Ka
(Po )
n KP = Ka
(Po )![]()
![]() Kc = Ka(RT/Po
)-
Kc = Ka(RT/Po
)-![]()
![]()
![]() .
.
Все четыре записи закона действующих масс
(через Ka, Kx, KP и Kc) могут
быть использованы при расчете состава
равновесной смеси, но только Ka вычисляется
по соответствующим значениям ![]() Go
,
Go
, ![]() Ho и
Ho и ![]() So
. Если при термодинамических расчетах
используется константа KP, то
So
. Если при термодинамических расчетах
используется константа KP, то
![]() .
.
Если размерность давления (и KP ) - [атм],
то Po = 1 и ![]() .
.
Зависимость константы скорости химической реакции от температуры:
Ур-ние изотермы реакции:
![]()
Условие химического равновесия: (![]() rG)P,T = 0 или (
rG)P,T = 0 или (![]() rF)V,T = 0, тогда
rF)V,T = 0, тогда
![]() .
.
С помощью этой формулы можно рассчитать выход продукта (или степень превращения).
Ур-ние изохоры реакции: ![]() при V = const.
при V = const.
ур-ние изобары реакции:![]() при P = const.
при P = const.
Если ![]() не зависит от
T, то:
не зависит от
T, то: ![]() ;
; 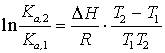 .
.
Константа диссоциации термодинамическая – константа равновесия реакции АВ " A+ + B- (см. также степень диссоциации)
![]() ,
,
где ![]() - кажущаяся
константа диссоциации.
- кажущаяся
константа диссоциации.
Константа криоскопическая (см. раствор
предельно разбавленный)
Константа эбулиоскопическая (см. раствор предельно
разбавленный)
Концентрация – величина, характеризующая относительное содержание данного компонента в многокомпонентной системе.
Массовая доля wi ![]() .
.
Мольная доля xi ![]() .
.
Моляльность mi- количество i-го компонента (в молях) в 1000 г растворителя
![]() .
.
Молярность сi - количество i-го
компонента в молях в 1 л раствора ![]() .
.
Переход (индекс 1 относится к растворителю, 2 - к растворенному веществу):
молярность ![]() моляльность:
моляльность: ![]() ;
;
моляльность ![]() мольная доля:
мольная доля: ![]()
коэффициент активности (см. активность)
коэффициент вириальный (см. ур-ние
состояния)
коэффициент изотонический i
(коэффициент Вант-Гоффа) – число, показывающее во
сколько раз общее количество частиц в растворе
больше, чем количество молекул электролита (N):
![]()
(![]() - степень диссоциации, v -
количество ионов, на которое распадается
молекула электролита)
- степень диссоциации, v -
количество ионов, на которое распадается
молекула электролита)
коэффициенты калорические
| l= = |
h= = |
cV = = |
cP= = |
c = = |
= |
коэффициенты термические:
изобарный коэффициент расширения |
адиабатный коэффициент сжимаемости | изотермический коэффициент сжимаемости | изохорный коэффициент давления |
(V0 - молярный объем при 0 К)
Летучесть fB
(фугитивность) – величина, имеющая размерность давления и определяемая равенствомКоэффициент фугитивности – ![]()
Парциальная мольная величина компонента (п.м.в.к.) – частная производная от любой экстенсивной переменной (Z) по количеству данного компонента (в молях) при постоянных давлении, температуре и числах молей каждого из остальных компонентов многокомпонентной термодинамической системы:
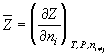 .
.
Прим.: химический потенциал ![]() i
i 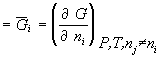 - парциальная мольная энергия Гиббса;
парциальный мольный объем 2-х компонентного р-ра
- парциальная мольная энергия Гиббса;
парциальный мольный объем 2-х компонентного р-ра 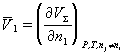 . П.м.в.к. раствора связаны
между собой следующими уравнениями:
. П.м.в.к. раствора связаны
между собой следующими уравнениями: ![]() (ур-ние Гиббса-Дюгема)
и
(ур-ние Гиббса-Дюгема)
и ![]() ,
, ![]() .
.