Теплоемкость сP, cV [Дж. моль-1. К-1, кал. моль-1. К-1]
Истинная молярная теплоемкость:
при V = const cV =![]() ; P = const cP =
; P = const cP =![]() .
.
Средняя молярная теплоемкость численно
равна теплоте, которую надо сообщить одному молю
вещества, чтобы нагреть его на 1 К: ![]() . Истинная и средняя теплоемкости
связаны между собой следующим образом:
. Истинная и средняя теплоемкости
связаны между собой следующим образом:
![]() ;
; 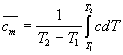 .
.
Теплоемкости при постоянном давлении или объеме связаны равенством
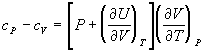 ;
;
для идеального газа ![]() ;
;
для крист. вещества ![]() (
(![]() ,
, ![]() T
- термические коэффициенты).
T
- термические коэффициенты).
Температурная зависимость теплоемкости
многих одноатомных кристаллов при T < q D/12
описывается законом кубов Дебая (q D -
характеристическая температура Дебая) cV = aT3,
при T![]()
![]() cV
cV ![]() 3R. В области средних температур
применяют различные степенные полиномы (см.,
напр., закон Кирхгофа).
3R. В области средних температур
применяют различные степенные полиномы (см.,
напр., закон Кирхгофа).
Правило Дюлонга и Пти: атомная теплоемкость
при V = const для любого простого
кристаллического вещества приблизительно равна
сV ![]() 3R (т.е. 25 Дж.
моль-1. К-1).
3R (т.е. 25 Дж.
моль-1. К-1).
Правило аддитивности: ![]() (сP,i - теплоемкость составляющих
соединение структурных фрагментов, напр., атомов
или групп атомов).
(сP,i - теплоемкость составляющих
соединение структурных фрагментов, напр., атомов
или групп атомов).
Теплота [Дж. моль-1, кал. моль-1] Q
– форма передачи энергия от более нагретого тела к менее нагретому, не связанная с переносом вещества и совершением работы.Теплота химической реакции при постоянном объеме или давлении (т.е. тепловой эффект химической реакции) не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы (закон Гесса):
![]() =
= ![]() U,
U, ![]() =
= ![]() H.
H.
Разность тепловых эффектов при P = const (QP)
и V = const (QV) равна работе, которая
совершается системой (![]() V>0) или
над системой (
V>0) или
над системой (![]() V<0) за счет
изменения ее объема при завершении
изобарно-изотермической реакции:
V<0) за счет
изменения ее объема при завершении
изобарно-изотермической реакции:
![]() -
- ![]() =
= ![]() n RT.
n RT.
Стандартная теплота реакции ![]() может быть рассчитана через
стандартные теплоты образования (
может быть рассчитана через
стандартные теплоты образования (![]() ) или сгорания (
) или сгорания (![]() ) веществ:
) веществ:
![]()
![]()
где n i,j - стехиометрические коэффициенты в уравнении химической реакции.
Для идеальных газов при T,P = const: ![]() rH =
rH = ![]() rU
+
rU
+ ![]() n RT.
n RT.
Зависимость теплового эффекта химической реакции от температуры определяется законом Кирхгофа.
![]() =
= 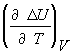 =
= ![]()
![]() ,
, ![]()
![]() =
= 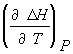 =
= ![]()
![]() ,
,
т.е. влияние температуры на тепловой эффект реакции обусловлено разностью теплоемкостей продуктов реакции и исходных веществ c учетом стехиометрических коэффициентов:
![]() .
.
При P = const:
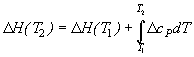 .
.
Если температурная зависимость ![]() cP аппроксимирована
уравнением
cP аппроксимирована
уравнением
![]()
![]() = a
+ b. T + c.
= a
+ b. T + c. ![]() ,
то
,
то
![]() H(T2) =
H(T2) = ![]() H(T1)+ а.
H(T1)+ а. 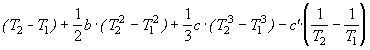 .
.
Теплота адсорбции – отнесенная к одному молю вещества теплота, которая выделяется при его адсорбции. Адсорбция – всегда экзотермический процесс (Q > 0). При постоянной адсорбции (Г, q = const):
![]() ,
, ![]() .
.
Величина Q является косвенным критерием
определения типа адсорбции: если Q < 30![]() 40 кДж/моль) – физическая адсорбция,
Q > 40 кДж/моль – хемосорбция.
40 кДж/моль) – физическая адсорбция,
Q > 40 кДж/моль – хемосорбция.
Теплота образования – изобарный тепловой эффект химической реакции образования данного химического соединения из простых веществ, отнесенный к одному молю этого соединения. При этом считают, что простые вещества реагируют в той модификации и том агрегатном состоянии, которые устойчивы при данной температуре и давлении 1 атм.
Теплота сгорания (т.с.) – тепловой эффект сгорания 1 моля вещества и охлаждения продуктов реакции до первоначальной температуры смеси. Т.С., если не оговорено особо, отвечает сгоранию С до СО2, H2 до H2O (ж.), для остальных веществ в каждом случае указывают продукты их окисления.
Теплота фазового перехода – теплота, поглощаемая (выделяемая) в результате равновесного перехода вещества из одной фазы в другую (см. переход фазовый).
Термодинамические переменные (т.п.)
– величины, количественно выражающие термодинамические свойства. Т.П. разделяют на независимые переменные (измеряемые в опыте) и функции. Прим.: давление, температура, элементный химический состав - независимые т.п., энтропия, энергия - функции. Набором значений независимых переменных задается термодинамическое состояние системы (см. также ур-ние состояния). Переменные, которые фиксированы условиями существования системы, и, следовательно, не могут изменяться в пределах рассматриваемой задачи, называют термодинамическими параметрами.Экстенсивные – т.п., пропорциональные количеству вещества или массе системы. Прим.: объем, энтропия, внутренняя энергия, энтальпия, энергии Гиббса и Гельмгольца, заряд, площадь поверхности.
Интенсивные – т.п., не зависящие от количества вещества или массы системы. Прим.: давление, термодинамическая температура, концентрации, мольные и удельные термодинамические величины, электрический потенциал, поверхностное натяжение. Экстенсивные т.п. складываются, интенсивные - выравниваются.
Уравнение
ур-ние адиабаты (идеальный газ) ![]() ;
;
ур-ние Аррениуса (см. скорость реакции,
эквивалентная электропроводность);
ур-ние Брунауера-Эммета-Теллера (БЭТ) (см. адсорбция);
ур-ние Гиббса фундаментальное (см. функции
характеристические);
ур-ние Гиббса-Дюгема (см. парциальная
мольная величина компонента, потенциал
химический);
ур-ние Гиббса-Гельмгольца (см. энергия
Гиббса, см. энергия Гельмгольца).
Кинетическое уравнение реакции – уравнение, выражающее зависимость скорости реакции от концентрации реагирующих веществ: w = k. [A]a[B]b[C]c;
кинетическое уравнение реакции n-го порядка:
| поря-док р-и | кинетическое уравнение | решение кинетического уравнения |
|
| n = 0 | [A] = [A]o - kt; x = kt | ||
| n = 1 | [A] = [A]oe-kt; x = [A]o(1-e-kt) | ||
| n = 2 | концентрации исходных веществ
одинаковы [A]o=[B]o
концентрации исходных веществ различны [A]o
|
|
|
| поря-док р-и | кинетическое уравнение | решение кинетического уравнения |
|
| n | концентрации исходных веществ
одинаковы
|
|
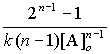 |
ур-ние Кирхгофа (см. теплота);
ур-ние Клапейрона-Клаузиуса (см. переход
фазовый);
ур-ние Максвелла (см. функции
характеристические).
Уравнение состояния (у.с.) – уравнение, связывающее любую термодинамическую переменную системы с переменными, принятыми в качестве независимых. У.с., связывающее для однородного тела P, V и T, называют термическим уравнением состояния.
У.с. состояния жидкости и твердого тела V ![]() const.
const.
Для идеального газа: PV = nRT ;
для неидеального газа, например:
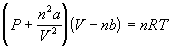 - уравнение
Ван-дер-Ваальса ( a, b - параметры);
- уравнение
Ван-дер-Ваальса ( a, b - параметры);
ур-ние с вириальными коэффициентами:
![]() ,
,![]() .
.
Ур-ние Шредера (см. растворимость);
уравнение Френдлиха (см. адсорбция).
Фаза
– гомогенная часть гетерогенной термодинамической системы, ограниченная поверхностью раздела, при переходе через которую происходит скачкообразное изменение свойств.