Функции
состояния термодинамической системы– функции, изменение которых не зависит от того, через какие промежуточные стадии идет процесс, а определяется только начальным и конечным состоянием системы.
характеристические (х.ф.) – функции состояния термодинамической системы, посредством которых и их производных по соответствующим независимым переменным могут быть выражены в явном виде все термодинамические свойства системы. Прим.: энтропия S; внутренняя энергия U является х.ф., если независимые параметры - S и V; энтальпия H - если S и P; энергия Гельмгольца F - если V и T; энергия Гиббса G - если P и T.
dU = TdS - PdV, dH = TdS + VdP,
dF = -SdT - PdV, dG = -SdT + VdP.
Для открытой системы с учетом изменения числа молей:
dU = TdS - PdV![]()
![]() (фундаментальное
ур-ние Гиббса),
(фундаментальное
ур-ние Гиббса),
здесь Xi - обобщенные силы, т.е.
параметры, не зависящие от размеров системы и
аналогичные силам в механике (напр., ![]() - поверхностное натяжение,
- поверхностное натяжение, ![]() - электрический потенциал, H -
напряженность магнитного поля), xi -
обобщенные координаты (соответственно силам: W -
поверхность, е - заряд, В - магнитная
индукция).
- электрический потенциал, H -
напряженность магнитного поля), xi -
обобщенные координаты (соответственно силам: W -
поверхность, е - заряд, В - магнитная
индукция).
Уравнения Максвелла позволяют выразить неизмеримые на опыте величины (т.е. термодинамические функции) через независимые термодинамические переменные:
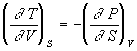 ,
, 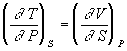 ,
,
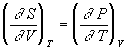 ,
, 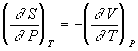
Число переноса ti иона
– отношение количества электричества, перенесенного данным видом ионов, к общему количеству электричества, перенесенного всеми ионами;Для бинарного электролита КА, диссоциирующего на ионы К z+ и А z-, число переноса связано с подвижностями ионов:
t+=![]() , t-=
, t-=![]()
Электрическая проводимость (э.п.)
характеризует способность вещества проводить ток, она обратно пропорциональна электрическому сопротивлению, имеет размерность [Ом-1= См (сименс)].Удельная электропроводность c [сопротивление-1длина-1]
определяется количеством ионов, переносящих
электричество (![]() с), где
с), где ![]() – степень диссоциации электролита,
и их абсолютной подвижностью (u+, u-):
– степень диссоциации электролита,
и их абсолютной подвижностью (u+, u-):
c =![]() .
.
Она численно равна проводимости слоя электролита, находящегося между двумя противоположными гранями куба единичной площади:
![]() ,
,
(F – число Фарадея, I – сила тока, U – разность потенциалов, l – длина проводника, s – площадь его поперечного сечения).
Эквивалентная электропроводность ![]() [сопротивление-1. длина
2. г-экв-1] – мера электрической
проводимости всех ионов, образующихся при
диссоциации 1 г-экв электролита при данной
концентрации. Она соответствует э.п. такого
объема раствора, в котором содержится 1 г-экв
растворенного вещества и электроды находятся на
единичном расстоянии друг от друга:
[сопротивление-1. длина
2. г-экв-1] – мера электрической
проводимости всех ионов, образующихся при
диссоциации 1 г-экв электролита при данной
концентрации. Она соответствует э.п. такого
объема раствора, в котором содержится 1 г-экв
растворенного вещества и электроды находятся на
единичном расстоянии друг от друга:
![]() = c . V = c
/c.
= c . V = c
/c.
Эквивалентная электропроводность выражается
через подвижности ионов ![]() +(-):
+(-):
![]() =
= ![]() =
= ![]() . (
. (![]() + +
+ + ![]() -) .
-) .
Эквивалентная электропроводность при
бесконечном разведении ![]()
![]() – электропроводность
гипотетического бесконечно разбавленного
раствора, характеризующегося полной
диссоциацией электролита и отсутствием сил
электростатического взаимодействия между
ионами. Она равна сумме предельных
подвижностей катионов и анионов (закон
Кольрауша):
– электропроводность
гипотетического бесконечно разбавленного
раствора, характеризующегося полной
диссоциацией электролита и отсутствием сил
электростатического взаимодействия между
ионами. Она равна сумме предельных
подвижностей катионов и анионов (закон
Кольрауша):
![]() =
= ![]() +
+![]() .
.
Для растворов слабых электролитов ![]() =
= ![]() .
.
![]() (уравнение Аррениуса),
(уравнение Аррениуса),
для сильных ![]() , где A=const
(эмпирический закон Кольрауша).
, где A=const
(эмпирический закон Кольрауша).
Электрод
– электрохимическая система, состоящая, как правило, из электронного проводника (1-го рода: металл, уголь) и ионного проводника (2-го рода: раствор или расплав электролита).Тип электрода |
Потенциалобразующая реакция |
Электродный потенциал
|
| амальгамный Mez+з |
Mez+ + ze- |
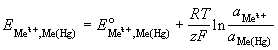 |
| водородный H3O+з |
2H3O+ + 2e-
|
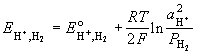 |
| кислородный H2O, OH- |
O2 + H2O + 4e- |
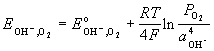 |
| хлорсеребряный Cl- |
AgCl + e- |
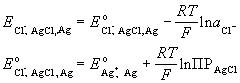 |
| каломельный KCl |
Hg2Cl2 + 2e- |
|
| хингидронный C6H4O2.
C6H4(OH)2,H+ |
C6H4O2 + 2H++ 2e-
|
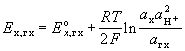 |
Электродвижущая сила (ЭДС) [В, мВ]
– разность потенциалов правильно разомкнутой электрохимической цепи; равна разности электродных потенциалов правого и левого электродов. Стандартная ЭДС равна разности стандартных потенциалов. Если диффузионный потенциал можно устранить или пренебречь им, то ЭДС цепи определяется величиной максимальной полезной работы г.э. Для обратимой реакции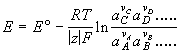 .
.
ЭДС г.э. связана с энергией Гиббса, энтальпией и энтропией электрохимической реакции
![]() .
.
Энергия [Дж, кал, Дж. моль-1, кал. моль-1]
Энергия активации – энергия, необходимая для того, чтобы столкнувшиеся молекулы вступили в реакцию; обычно принимают, что EА не зависит от температуры. Если известны значения константы скорости реакции при двух различных температурах:
![]() .
.
Энергия активации опытная ![]() , Еоп = ЕА,
если предэкспоненциальный множитель в выражении
для константе скорости не зависит от
температуры.
, Еоп = ЕА,
если предэкспоненциальный множитель в выражении
для константе скорости не зависит от
температуры.
Энергия внутренняя U – функция состояния термодинамической системы, определяемая тем, что ее приращение в любом процессе, происходящем в этой системе, равно сумме теплоты, сообщенной системе, и работы, совершенной над ней:
dU = TdS - ![]() A = TdS - PdV +
A = TdS - PdV + ![]() A*,
A*,
где PdV - работа расширения, A* - сумма всех остальных видов элементарных работ (электрическая , магнитная и т.п.). Внутренняя энергия идеального газа не зависит ни от объема, ни от давления и является функцией только температуры:
![]() ,
, ![]()
(см. также ур-ние изохоры реакции) .
Энергия Гиббса G – функция состояния термодинамической системы, равная разности между энтальпией и произведением температуры на энтропию:
G = H - TS = U - TS + PV = A + PV,
G = H + T![]() (ур-ние Гиббса-Гельмгольца),
(ур-ние Гиббса-Гельмгольца),
dG = VdP - SdT, ![]() G =
G = ![]() H - T
H - T![]() S при Т = const.
S при Т = const.
Убыль энергии Гиббса в равновесном процессе,
протекающем при P,T = const, равна
максимальной полезной работе, произведенной
системой. Величина ![]() G является
критерием направленности самопроизвольного
процесса в закрытой системе при P,T = const:
при
G является
критерием направленности самопроизвольного
процесса в закрытой системе при P,T = const:
при ![]() G < 0 процесс идет
в прямом направлении, при
G < 0 процесс идет
в прямом направлении, при ![]() G > 0
- в обратном, при
G > 0
- в обратном, при ![]() G = 0
реализуется состояние равновесия.
G = 0
реализуется состояние равновесия.
Для идеального газа : G(P,T) = Go
(Po ,T) + nRTln![]()
при T=const ![]() G =
G = ![]() F +
F + ![]() n RT
n RT
Для химической реакции 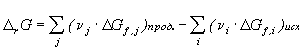
(см. также константа равновесия, ур-ние изотермы)
Энергия Гельмгольца F – функция состояния термодинамической системы, равная разности между внутренней энергией и произведением температуры на энтропию
F = U - TS ; F = U + T![]()
![]() F =
F = ![]() U - T
U - T![]() S при
Т = const.;
S при
Т = const.;
dF = dU - TdS - SdT = -PdV - SdT
Убыль энергии Гельмгольца в равновесном
процессе, протекающем при V,T = const,
равна максимальной полезной работе,
произведенной системой. Величина ![]() F является критерием
направленности самопроизвольного процесса в
закрытой системе при V,T = const: при
F является критерием
направленности самопроизвольного процесса в
закрытой системе при V,T = const: при ![]() F < 0 процесс идет в
прямом направлении, при
F < 0 процесс идет в
прямом направлении, при ![]() F > 0
- в обратном, при
F > 0
- в обратном, при ![]() F = 0
реализуется состояние равновесия.
F = 0
реализуется состояние равновесия.
Для идеального газа : F(P,T) = Fo
(Po ,T) + RTln![]()
при T=const ![]() G =
G = ![]() F +
F + ![]() n RT
n RT
Энтальпия H [энергия. моль-1 (Дж. моль-1, кал. моль-1)]
– функция состояния термодинамической системы, равная сумме внутренней энергии и произведения объема на давление:H = U + PV.
Энтропия S [энергия. моль-1 К-1 (Дж. моль-1К-1, кал. моль-1К-1 = э.е.)]
– функция состояния термодинамической системы, определяемая тем, что ее дифференциал (dS) при элементарном равновесном (обратимом) процессе равен отношению бесконечно малого количества теплоты (Абсолютное значение энтропии можно рассчитать, напр., по формулам:
S = kB. lnW,
где W - термодинамическая вероятность состояния, определяемая числом микросостояний, реализующих данное макросостояние;
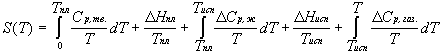 .
.
Формулы для расчета изменения энтропии системы в ходе различных процессов приведены в следующей таблице:
Процесс |
Формула для расчета |
| нагревание (охлаждение) n молей вещества от T1 до T2 при P = const или V = const | 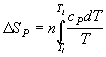 , , 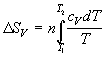 |
Процесс |
Формула для расчета |
| нагревание n молей идеального газа от T1 до T2 при P = const или V = const |
|
| фазовый переход при Ttr | |
| изотермическое расширение n молей идеального газа | |
| нагревание n молей идеального газа от T1 до T2 | при V=const: при P=const: |
| при смешении n1 и n2 молей идеальных газов (при P = const и T = const); V=V1+V2 | 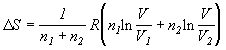 |
| при смешении n1 и n2 молей идеальных газов с одинаковыми парциальными давлениями PA = PB | |
| химическая реакция |
|
Расчет энтропии системы и окружения при изотермическом расширении газа
| Процесс |
|
|
| обратимый | ||
| необратимый P = const P = 0 (вакуум) |
|
|
Энтропия испарения в нормальной точке кипения
для очень многих жидкостей ![]() Sv = 21.3
кал. моль-1К-1 = 89.1 Дж.
моль-1К-1 (правило Трутона).
Sv = 21.3
кал. моль-1К-1 = 89.1 Дж.
моль-1К-1 (правило Трутона).
Приложение
Математические постоянные величины
![]() = 3.142
= 3.142
е = 2.718
e-1 = 0.368
lg(e) = 0.434
ln(10) = 2.302
Физические постоянные величины
Абсолютная температура точки плавления льда (0o
С) 273.150 К.
Абсолютная температура тройной точки воды 273.160 К.
Молярный объём для идеального газа 22.414 л.
моль-1 (при 273,15К, 101325Па).
Постоянная Планка h = 6.626. 10-34
Дж. cек
Постоянная Больцмана k = R/NA = 1.3806.
10-23 Дж. K-1.
Газовая постоянная
R = 8.314 Дж. K-1. моль-1
R = 1.987 кал. K-1. моль-1 = 82.057
см3. атм. К-1. моль-1
Элементарный заряд e = 1.602. 10-19
кулон
Число Авогадро NA = 6.0225. 1023 моль-1.
Число Фарадея F = 96493.5 кулон г-экв-1.
Переводные множители
1 Дж = 1 Н. м = 1 кг. м2. сек-2
= 0.239 кал = 107 эрг
1 кал = 4,184 Дж.
1 л-атм = 101.325 Дж = 24.217 кал
1 эВ =1.602. 10-19 Дж
1 квт. час = 3600 кДж.
1 атм = 101325 Па = 101325 Н. м-2 = 1.01325 бар = 760 мм
рт. ст. ![]()
1 бар = 105 Па
Литература