|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание] [следующий
раздел]
§ 12. Оксокислоты халькогенов Э(VI):
получение, строение, свойства.
Оксокислоты халькогенов (VI) H2SO4,
H2SeO4 и H6TeO6 синтезируют
окислением их диоксидов (или соответствующих им
кислот):
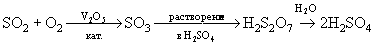
H2SeO3 + Н2О2  H2SeO4 + Н2О H2SeO4 + Н2О
5TeO2 + 2KMnO4 + 6HNO3 + 12 Н2О 5H6TeO6 + 2KNO3
+ 2Mn(NO3)2 , 5H6TeO6 + 2KNO3
+ 2Mn(NO3)2 ,
а также окислением простых веществ сильными
окислителями:
5Te + 6HClO3 + 12H2O  5H6TeO6 + 3Cl2 , 5H6TeO6 + 3Cl2 ,
или обменными реакциями:
BaTeO4 + H2SO4 + 2H2O  H6TeO6 + BaSO4. H6TeO6 + BaSO4.
В молекуле H2SO4 сера тетраэдрически
окружена двумя гидроксильными (ОН) группами и
двумя атомами кислорода. Длины связей
(расстояние S- ОН равно 1.54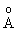 , а расстояние S- О равно 1.43 , а расстояние S- О равно 1.43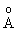 ) в молекуле H2SO4 таковы,
что связи S- О можно считать двойными, а связи S- ОН
- одинарными. Бесцветные, похожие на лед
кристаллы H2SO4 имеют слоистую
структуру, в которой каждая молекула H2SO4 соединена
с четырьмя соседними молекулами прочными
водородными связями, образуя единый
пространственный каркас. При температуре 10.48оС
H2SO4 плавится с образованием тяжелой (d
= 1.838 г/мл при 15оС) маслянистой жидкости,
кипящей при 280оС. У жидкой H2SO4
структура почти такая же, как у твердой, только
целостность пространственного каркаса нарушена,
и его можно представить как совокупность
микрокристалликов, постоянно меняющих свою
форму. H2SO4 смешивается с водой в любых
соотношениях, что сопровождается образованием
гидратов H2SO4. n H2O (рис.8).
Теплота гидратации настолько велика, что смесь
может даже закипеть. ) в молекуле H2SO4 таковы,
что связи S- О можно считать двойными, а связи S- ОН
- одинарными. Бесцветные, похожие на лед
кристаллы H2SO4 имеют слоистую
структуру, в которой каждая молекула H2SO4 соединена
с четырьмя соседними молекулами прочными
водородными связями, образуя единый
пространственный каркас. При температуре 10.48оС
H2SO4 плавится с образованием тяжелой (d
= 1.838 г/мл при 15оС) маслянистой жидкости,
кипящей при 280оС. У жидкой H2SO4
структура почти такая же, как у твердой, только
целостность пространственного каркаса нарушена,
и его можно представить как совокупность
микрокристалликов, постоянно меняющих свою
форму. H2SO4 смешивается с водой в любых
соотношениях, что сопровождается образованием
гидратов H2SO4. n H2O (рис.8).
Теплота гидратации настолько велика, что смесь
может даже закипеть.
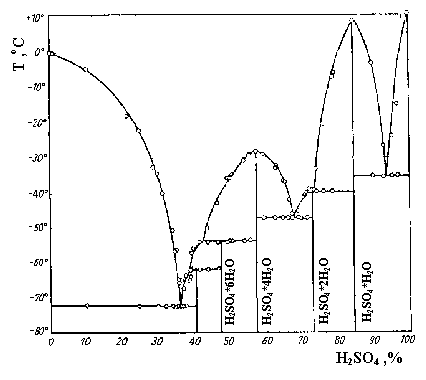
Рис.8. Т-х диаграмма системы H2O-H2SO4.
Жидкая H2SO4 удивительно похожа на
воду со всеми структурными особенностями и
аномалиями. Здесь та же система сильных
водородных связей, что и в воде, почти такой же
прочный пространственный каркас, такие же
аномально высокие вязкость, поверхностное
натяжение, температуры плавления и кипения.
Диэлектрическая проницаемость H2SO4 велика
(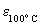  100). По этой причине собственная
диссоциация (автоионизация) у серной кислоты
заметно больше, чем у воды: 2H2SO4 100). По этой причине собственная
диссоциация (автоионизация) у серной кислоты
заметно больше, чем у воды: 2H2SO4  H3SO4+
+ HSO4- , К = 2.7 . 10-4 . H3SO4+
+ HSO4- , К = 2.7 . 10-4 .
Из-за высокой полярности связь Н- О легко
разрывается, причем отщепление протона требует
меньших энергетических затрат, чем у воды. По
этой причине кислотные свойства у H2SO4 выражены
сильно и при растворении в безводной H2SO4
большинство соединений, традиционно считавшихся
кислотами (CH3COOH, HNO3, H3PO4 и
др.), ведут себя как основания, вступая в реакции
нейтрализации и повышая концентрацию анионов 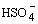 : :
H2O + H2SO4  H3O+ + H3O+ + 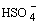 , ,
основание
CH3COOH + H2SO4  CH3C(OH)2+ + CH3C(OH)2+ + 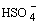 , ,
основание
HNO3 + 2 H2SO4  NO2+ + H3O+ +2 NO2+ + H3O+ +2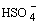 , ,
основание
Лишь несколько соединений (HClO4, FSO3H)
при растворении в H2SO4 ведут себя как
слабые кислоты, то есть протон у них отщепляется
легче, чем у H2SO4, что приводит к росту
концентрации сольватированного протона 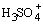 , например, , например,
HSO3F + H2SO4  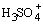 + SO3F- . + SO3F- .
кислота
Некоторые свойства оксокислот халькогенов (VI)
приведены в табл.9.
Таблица 9.Свойства оксокислот
халькогенов Э(VI).
| |
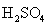
|
H2SeO4 |
H2TeO4 . 2H2O=H6TeO6 |
| pK1: Н2ЭО4 =Н++НЭO4- pK2:
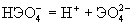 |
- 3.0
1.92 |
- 1.0
2.0 |
7.7
- |
| Ео, В; рН = 0: 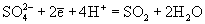
|
0.16 |
|
|
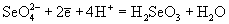 |
|
1.15 |
|
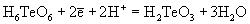 |
|
|
1.04 |
| Ео, В; рН = 14: 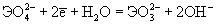
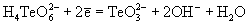
|
-0.93 |
0.03 |
+0.40 |
Серная и селеновая кислоты являются сильными
двухосновными кислотами и близки по структуре и
свойствам между собой. Их константы диссоциации
в водных растворах одного порядка (К2 для 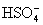 и и 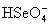 равны 1.2. 10-2 и 2.19. 10-2,
соответственно), селенаты изоморфны с сульфатами)
, образуя, например, квасцы состава МAl(SeO4)3
. 12H2O, где М - тяжелый щелочной
металл. равны 1.2. 10-2 и 2.19. 10-2,
соответственно), селенаты изоморфны с сульфатами)
, образуя, например, квасцы состава МAl(SeO4)3
. 12H2O, где М - тяжелый щелочной
металл.
Строение ортотеллуровой кислоты H6TeO6
отличается от строения серной и селеновой кислот
(сравнить с кислородными кислотами галогенов HClO4,
HBrO4 и H5IO6). Кристаллическая
структура твердой H6TeO6 (т.пл. 136оС)
построена из молекул правильной октаэдрической
формы, которые сохраняют свою форму и в
растворах. Теллураты не изоморфны с сульфатами и
селенатами. Ортотеллуровая кислота щелочью
титруется как одноосновная с образованием солей
MITeO(OH)5, она слабее угольной кислоты.
Получены продукты полного (Ag6TeO6 , Na6TeO6)
и частичного (NaH5TeO6, Na2H4TeO6,
Na4H2TeO6) замещения протонов
ионами металлов.
Селеновая кислота более сильный
окислитель, чем Н2SO4 и Н6ТеО6
(табл.9). Она растворяет без нагревания Cu и даже Au:
2Au + 6H2SеO4  Au2(SeO4)3 + 3 H2SeO3 + 2H2O,
окисляет ионы галогенидов, кроме фторида, до
свободных галогенов, под ее действием
воспламеняется клетчатка. Ортотеллуровая
кислота также более сильный окислитель, чем
серная кислота. Наиболее частым продуктом
восстановления H2SeO4 и H6TeO6
являются простые вещества.
Au2(SeO4)3 + 3 H2SeO3 + 2H2O,
окисляет ионы галогенидов, кроме фторида, до
свободных галогенов, под ее действием
воспламеняется клетчатка. Ортотеллуровая
кислота также более сильный окислитель, чем
серная кислота. Наиболее частым продуктом
восстановления H2SeO4 и H6TeO6
являются простые вещества.
Серная кислота обладает сильными
окислительными свойствами только в
концентрированном виде и при нагревании:
Cu + 2 H2SO4 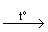 CuSO4
+ SO2 + 2H2O . CuSO4
+ SO2 + 2H2O .
Продуктами ее восстановления в зависимости от
условий проведения реакций могут быть SO2
(при избытке H2SO4), H2S, S, 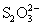 , политионаты (при
недостатке H2SO4). , политионаты (при
недостатке H2SO4).
В ряду 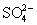 - - 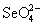 - H5Te - H5Te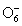 наблюдается аномалия в последовательности
изменения термодинамической cтабильности и
окислительной способности: селеновая кислота и
ее соли термодинамически оказываются менее
стабильными и более сильными окислителями,
чем соответствующие кислоты и соли S(VI) и Te(VI).
Наклон линии, соединяющей вольт-эквивалентные
пары
наблюдается аномалия в последовательности
изменения термодинамической cтабильности и
окислительной способности: селеновая кислота и
ее соли термодинамически оказываются менее
стабильными и более сильными окислителями,
чем соответствующие кислоты и соли S(VI) и Te(VI).
Наклон линии, соединяющей вольт-эквивалентные
пары 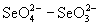 , больше, чем
наклон соответствующих линий для H6TeO6- H2TeO3
и , больше, чем
наклон соответствующих линий для H6TeO6- H2TeO3
и 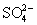 - H2SO3
(рис.7). Больший потенциал пары - H2SO3
(рис.7). Больший потенциал пары 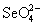 / / 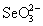 по сравнению с
парами H6TeO6 / H2TeO3 и по сравнению с
парами H6TeO6 / H2TeO3 и 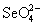 / H2SO3 приводит
к тому, что H2SеO4, например,
выделяет хлор из концентрированной HCl: H2SеO4
+ 2HCl = =Cl2 + H2SeO3 + H2O.
Аналогичные немонотонные изменения свойств
элементов и их соединений, в частности,
оксокислот, наблюдаются и для других элементов
4-го периода, например, / H2SO3 приводит
к тому, что H2SеO4, например,
выделяет хлор из концентрированной HCl: H2SеO4
+ 2HCl = =Cl2 + H2SeO3 + H2O.
Аналогичные немонотонные изменения свойств
элементов и их соединений, в частности,
оксокислот, наблюдаются и для других элементов
4-го периода, например, 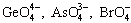 ,
и иногда называются вторичной периодичностью .
Можно полагать, что рассматриваемые аномалии
связаны с понижением прочности связи Se- O по
сравнению со связью S- O. В свою очередь, это
вызвано увеличением размера и энергий 4s- и
4p-орбиталей атома селена по сравнению с размером
и энергиями 2s- и 2p-орбиталей кислорода, и
следовательно, с уменьшением взаимодействия
(перекрывания) 4s-, 4p-орбиталей селена и 2s,
2p-орбиталей кислорода (энергии 2s-, 2p-, 3s-, 3p-, 4s- и
4p-атомных орбиталей составляют - 32.4, - 15.9, - 20.7, - 12.0,
- 17.6 и - 9.1эВ, соответственно). Повышение
стабильности и уменьшение окислительной
способности оксосоединений при переходе от Se(VI) к
Te(VI) обусловлено особенностями строения и
увеличением прочности связи Te- O в октаэдрических
ионах TeO6 по сравнению со связью Se- O в
тетраэдрах ,
и иногда называются вторичной периодичностью .
Можно полагать, что рассматриваемые аномалии
связаны с понижением прочности связи Se- O по
сравнению со связью S- O. В свою очередь, это
вызвано увеличением размера и энергий 4s- и
4p-орбиталей атома селена по сравнению с размером
и энергиями 2s- и 2p-орбиталей кислорода, и
следовательно, с уменьшением взаимодействия
(перекрывания) 4s-, 4p-орбиталей селена и 2s,
2p-орбиталей кислорода (энергии 2s-, 2p-, 3s-, 3p-, 4s- и
4p-атомных орбиталей составляют - 32.4, - 15.9, - 20.7, - 12.0,
- 17.6 и - 9.1эВ, соответственно). Повышение
стабильности и уменьшение окислительной
способности оксосоединений при переходе от Se(VI) к
Te(VI) обусловлено особенностями строения и
увеличением прочности связи Te- O в октаэдрических
ионах TeO6 по сравнению со связью Se- O в
тетраэдрах 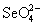 . Атом
теллура по сравнению в атомом селена имеет бу
льший радиус, для него характерно
координационное число 6. Увеличение числа
координируемых атомов кислорода приводит к
росту числа электронов на связывающих
молекулярных орбиталях и, соответственно, к
повышению прочности связи. . Атом
теллура по сравнению в атомом селена имеет бу
льший радиус, для него характерно
координационное число 6. Увеличение числа
координируемых атомов кислорода приводит к
росту числа электронов на связывающих
молекулярных орбиталях и, соответственно, к
повышению прочности связи.
[предыдущий раздел] [содержание] [следующий
раздел]
|

