|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание]
[следующий раздел]
§ 2.2. Кислород, озон: строение и
свойства.
Кислород - самый распространенный элемент на
Земле. Известно около 1500 минералов, содержащих
кислород. Вследствие жесткости электронной
оболочки для кислорода характерны слабое
межмолекулярное взаимодействие и низкие
температуры плавления и кипения (табл.2).
При 20оС растворимость О2 составляет
3.08 объема в 100 объемах воды. Растворимость в
соленой воде несколько ниже, но достаточна для
поддержания жизни в морях. Растворимость О2
в органических жидкостях на порядок выше.
Электронное строение молекулы О2
описывается на основе метода МО (рис.1а).
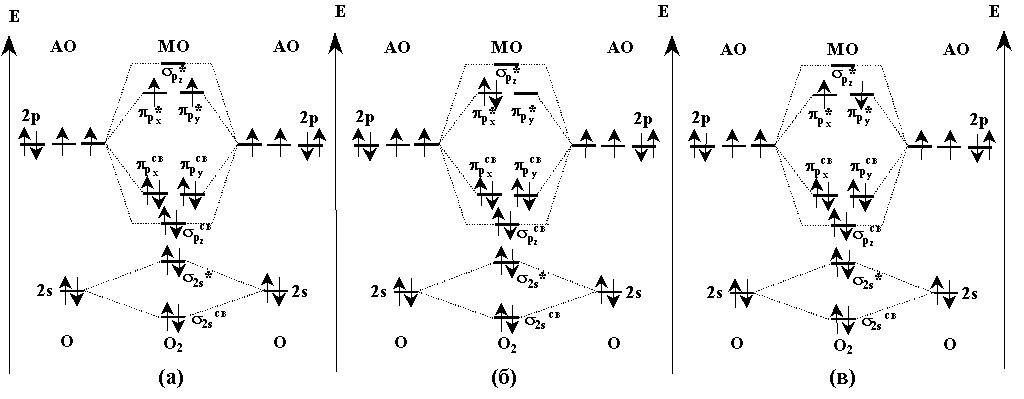
Рис.1. Схема молекулярных орбиталей молекулы
кислорода в основном (а) и двух возбужденных
состояниях (б) и (в).
На этой схеме по краям нанесены энергии атомных
орбиталей (АО), а в середине - молекулярных (МО).
Взаимодействующие атомные и образующиеся молекулярные
орбитали соединены пунктирными линиями. Две
нижние по энергии 2s- АО порождают две нижние
связывающую 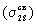 и разрыхляющую и разрыхляющую 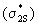 МО. Самой нижней по энергии
молекулярной орбиталью, образуемой двумя
наборами трижды вырожденных р-орбиталей,
является связывающая связывающая МО. Самой нижней по энергии
молекулярной орбиталью, образуемой двумя
наборами трижды вырожденных р-орбиталей,
является связывающая связывающая 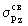 орбиталь,
поскольку орбиталь,
поскольку  -перекрывание pz- pz
АО больше, чем -перекрывание pz- pz
АО больше, чем 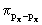 и и 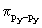 . Соответственно наибольшее
расщепление уровней приводит к тому, что самой
верхней по энергии является разрыхляющая . Соответственно наибольшее
расщепление уровней приводит к тому, что самой
верхней по энергии является разрыхляющая 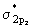 орбиталь. Между орбиталь. Между 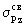 связывающей и связывающей и 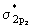 разрыхляющей орбиталями
находятся разрыхляющей орбиталями
находятся 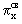 и и 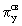 связывающие и связывающие и 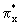 , , 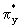 разрыхляющие МО. разрыхляющие МО. -молекулярные
орбитали дважды вырождены, так как перекрывание
рх и рy АО совершенно одинаково. По
сравнению с азотом энергия -молекулярные
орбитали дважды вырождены, так как перекрывание
рх и рy АО совершенно одинаково. По
сравнению с азотом энергия 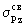 МО оказывается ниже, чем энергия МО оказывается ниже, чем энергия 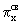 и и 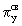 МО. Это обусловлено увеличением различия
энергий 2s- и 2р- АО у кислорода и уменьшением
взаимодействия однотипных МО. Это обусловлено увеличением различия
энергий 2s- и 2р- АО у кислорода и уменьшением
взаимодействия однотипных 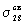 и и 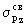 связывающих
молекулярных орбиталей. Наличие двух
неспаренных электронов с параллельными спинами
на дважды вырожденных разрыхляющих связывающих
молекулярных орбиталей. Наличие двух
неспаренных электронов с параллельными спинами
на дважды вырожденных разрыхляющих  *-орбиталях объясняет
парамагнетизм кислорода. Такое расположение
электронов соответствует триплетному состоянию
с межатомным расстоянием О-О 1.2074 *-орбиталях объясняет
парамагнетизм кислорода. Такое расположение
электронов соответствует триплетному состоянию
с межатомным расстоянием О-О 1.2074 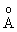 . Поскольку на связывающих орбиталях
молекулы находится на 4 электрона больше, чем на
разрыхляющих, формально можно считать в молекуле
О2 связь между атомами двойной. . Поскольку на связывающих орбиталях
молекулы находится на 4 электрона больше, чем на
разрыхляющих, формально можно считать в молекуле
О2 связь между атомами двойной.
Если при фотохимическом или химическом
возбуждении на одной  *-орбитали оказываются два электрона с
противоположными спинами, то возникает так
называемое синглетное состояние с общим
нулевым спином (рис.1б). Это состояние по энергии
расположено на 92 кДж/моль выше основного
состояния. Если же при возбуждении атома
кислорода два электрона занимают разные
*-орбитали оказываются два электрона с
противоположными спинами, то возникает так
называемое синглетное состояние с общим
нулевым спином (рис.1б). Это состояние по энергии
расположено на 92 кДж/моль выше основного
состояния. Если же при возбуждении атома
кислорода два электрона занимают разные  *-орбитали и имеют
противоположные спины, то возникает еще одно
возбужденное синглетное состояние с нулевым
спином (рис.1в). *-орбитали и имеют
противоположные спины, то возникает еще одно
возбужденное синглетное состояние с нулевым
спином (рис.1в).
Оно лежит на 155 кДж/моль выше основного состояния
молекулы О2. Возбуждение сопровождается
увеличением межатомных расстояний О- О: от 1.2074 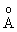 до 1.2155 до 1.2155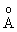 у первого (рис.1б) и до 1.2277 у первого (рис.1б) и до 1.2277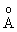 у второго (рис.1в) возбужденного
состояния, что, в свою очередь, приводит к
ослаблению связей О- О и к повышению химической
активности кислорода. Поэтому оба синглетные
состояния молекулы О2 играют важную роль в
реакциях окисления в газовой фазе. Поглощение в
видимой части спектра (красная-желтая-зеленая)
обеспечивает голубой цвет жидкого О2 в
возбужденном состоянии. у второго (рис.1в) возбужденного
состояния, что, в свою очередь, приводит к
ослаблению связей О- О и к повышению химической
активности кислорода. Поэтому оба синглетные
состояния молекулы О2 играют важную роль в
реакциях окисления в газовой фазе. Поглощение в
видимой части спектра (красная-желтая-зеленая)
обеспечивает голубой цвет жидкого О2 в
возбужденном состоянии.
В ряду N2- O2- F2 энергии
диссоциации (атомизации) равны 945.4, 493.8 и 158.8
кДж/моль, соответственно. Ослабление прочности
молекул приводит к резкому усилению химической
активности от азота к кислороду и особенно к
фтору. Многие реакции кислорода и фтора
экзотермические и протекают самопроизвольно.
Степени окисления кислорода в его
соединениях могут изменяться в широких границах:
+1/2(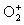 ), О(О3), -1/3( ), О(О3), -1/3(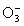 ), -1/2( ), -1/2(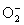 ), -1( ), -1(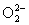 ) и -2(О2- ).
Координационные числа атома кислорода в
соединениях также весьма разнообразны: от О
(атомарный кислород), 1 (О2, СО), 2 (Н2О, Н2О2),
3 (Н3О+) до 4 (оксиацетаты Be и Zn), 6 (МgO, CdO)
и 8 (Na2O, Cs2O). ) и -2(О2- ).
Координационные числа атома кислорода в
соединениях также весьма разнообразны: от О
(атомарный кислород), 1 (О2, СО), 2 (Н2О, Н2О2),
3 (Н3О+) до 4 (оксиацетаты Be и Zn), 6 (МgO, CdO)
и 8 (Na2O, Cs2O).
Рассмотрим особенности строения и свойств озона.
Наличие трех атомов кислорода в молекуле озона О3
приводит к существенному изменению прочности
связи и свойств по сравнению с кислородом О2.
Озон получают действием электрического разряда
на кислород, при газовых разрядах, под действием
ультрафиолетового излучения.
Диамагнитная молекула О3 изогнутая:
валентный угол О- О- О равен 116.8о, расстояние
между центральным и концевыми атомами О равно 1.278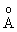 . Это расстояние меньше
длины одинарной связи (1.49 . Это расстояние меньше
длины одинарной связи (1.49 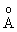 в Н2О2) и больше длины двойной
связи (1.21 в Н2О2) и больше длины двойной
связи (1.21 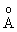 в О2). в О2).
Каждый атом O образует одну 1 -связь с
соседним атомом за счет р-электрона. Остальные
р-орбитали комбинируются с образованием одной
несвязывающей и одной разрыхляющей орбиталей.
Количество электронов точно соответствует
заселению связывающей и несвязывающей МО.
Поэтому электронную систему озона относят к четырехэлектронным
трехцентровым связям. Общий порядок каждой
связи О- О около 1.5: 1 -связь с
соседним атомом за счет р-электрона. Остальные
р-орбитали комбинируются с образованием одной
несвязывающей и одной разрыхляющей орбиталей.
Количество электронов точно соответствует
заселению связывающей и несвязывающей МО.
Поэтому электронную систему озона относят к четырехэлектронным
трехцентровым связям. Общий порядок каждой
связи О- О около 1.5: 1 -связывающей и 0.5 -связывающей и 0.5 -несвязывающей
МО. -несвязывающей
МО.
В кислой и щелочной средах озон - более сильный
окислитель, чем кислород;:
Восстановительными свойствами озон не
обладает. Таким образом, озон характеризуется
свойствами сильного окислителя и переносчика
атома О с выделением свободного О2. К числу
характерных реакций озона относится образование
озонидов щелочных МО3 и
щелочно-земельных М(О3)2 металлов при
пропускании озона в щелочные растворы.
Термическая устойчивость озонидов МО3 в
ряду Na<K<Rb<Cs и М(О3)2 в ряду Ca<Sr<Ba
соответствует возрастанию прочности
кристаллической решетки озонидов в группе
щелочных и в группе щелочно-земельных металлов.
Аналогично изменяется устойчивость пероксидов
этих металлов.
Помимо озона, кислород образует малоустойчивые
частицы О4 и 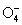 . .
[предыдущий раздел] [содержание]
[следующий раздел]
|

